《物理化学》课程教学课件(PPT讲稿)复习总结

1.热力学第一定律 热力学第一定律是能量守恒与转化定律在热现 象领域内所具有的特殊形式,说明热力学能、热和 功之间可以相互转化,但总的能量不变。 △U=U2-U1=2+W dU=δ2+δW
1 1. 热力学第一定律 热力学第一定律是能量守恒与转化定律在热现 象领域内所具有的特殊形式,说明热力学能、热和 功之间可以相互转化,但总的能量不变。 U Q W U U 2 1 = − = + dU Q W = +

2.定压热和定容热 (1) dU=8Q,(dV=0,δW=0) △U=2y δ2,=dH(dp=0,δW'=0) △H=Op def H=U+PV
2 2. 定压热和定容热 (1) dU QV = = U QV (d 0 ' 0 V W = = , ) d Q H p = = H Qp (d 0, ' 0) p W = = def H U pV = +

def (2) C(T) 6迴 (简单状态变化,W=0)》 dT G0= aU dT H=e,=∫C,dT (等压,非膨胀功为零的简单状态变化) △U=L,=∫C,dT(等容,非膨张功为零的简单状态变化心 3
3 (2) ( ) def d = Q C T T (简单状态变化, Wf=0 ) ( ) d p p Q C T T = p H T = ( ) d V V Q C T T = V U T = H Q C T = = p pd (等压,非膨胀功为零的简单状态变化) U Q C T = = V Vd (等容,非膨胀功为零的简单状态变化)
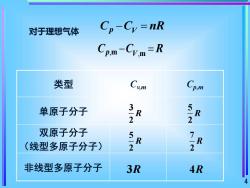
对于理想气体 Cp-Cy=nR Cp.M-Cym=R 类型 Cp 单原子分子 2 2 双原子分子 (线型多原子分子) >R 2 非线型多原子分子 3R 4R 4
4 对于理想气体 C C nR p V − = , p m V,m C C R − = 类型 Cv,m Cp,m 单原子分子 双原子分子 (线型多原子分子) 非线型多原子分子 3 2 R 5 2 R 7 2 R 5 2 R 3R 4R

3.理想气体可逆过程方程 (1)定温可逆过程 pV=K (2)绝热可逆过程 TVr-1 =K1 pV 7=K2 TYpl-Y=K3 式中,K,K2,K,均为常数,y=Cp/Cw 5
5 TV−1 = K1 pV = K2 T p 1−= K3 3. 理想气体可逆过程方程 (1)定温可逆过程 (2)绝热可逆过程 pV = K 式中, K K K 1 2 3 , , 均为常数, / C C p V =

4.过程W、Q、△U、△H的计算 (1)理想气体简单状态变化过程 AU-CdT-nCvdT △H=∫Cdr=n:Cndn w=jam-∫ -P.(V-V) (等外压) 0 (恒容) AU=∫C,dn(绝热) Q=AU-w-jpu=-nr哈 (定温可逆)) 6
6 4.过程W、Q、ΔU、 ΔH的计算 (1)理想气体简单状态变化过程 2 2 1 1 , T T V V m T T = = U C dT n C dT 2 2 1 1 , T T p p m T T = = H C dT n C dT W p dV = − = e 2 1 ( ) e − − p V V (等外压) 0 (恒容) U (绝热) 2 1 T V T = C dT Q = − U W 2 1 lnV pdV nRT V − = − (定温可逆)

(2)相变化过程 可逆相变 △H=n△相Hm △U=Q+W=△H-p△V w=-∫p.dw=-∫pw=-pw-) =-pV=-nRT (末态为气态,且 为理想气体) 2p=△H 不可逆相变 △U和△H可通过在始终态间设计过程计 算,W和Q必须按照实际途径计算
7 (2)相变化过程 可逆相变 = H n H相 m W e = − = − p dV pdV 2 1 = − − p V V ( ) g = − = − pV nRT (末态为气态,且 为理想气体) = + U Q W = − H p V Q H p = 不可逆相变 ΔU和ΔH可通过在始终态间设计过程计 算,W和Q必须按照实际途径计算

(3)化学变化过程 AH=5·△,H=5∑yAH)=5(-∑y△.H品) △U=5·△,UR=5A,H-∑y,RT) (定压)》 . (定容) Q=△H (定压,W'=0) Q=△U (定容,W=0)》
8 (3)化学变化过程 r m H H = ( ) B f m H = ( ) B c m H = − U Ur m = ( ) r m g H RT = − W p dV = − e ( ) g = − = − p V n RT (定压) = 0 (定容) Q H = (定压, W’=0) Q = U (定容, W’=0)

6.Kirchhoff定律 T: aD+eE+. △rHm(T) →fF+gG+ AH() D+eE+ Ha )→F+gG+ △H(I)=△,H(T)+△C,dT ACp=∑VCnm(B) 如在该温度区间内有物质发生相变,就要分段积分。 9
9 6.Kirchhoff定律 2 1 r m 2 r m 1 ( ) ( ) d T p T = + H T H T C T B ,m B (B) = C C p p 如在该温度区间内有物质发生相变,就要分段积分。 1 r m 1 ( ) : D E F G H T T d e f g + + ⎯⎯⎯⎯⎯→ + + 2 r m 2 ( ) : D E F G H T T d e f g + + ⎯⎯⎯⎯⎯⎯→ + + H(1) H(2)

1.热机的效率 =1- _2+2=1+ T 2 22 2, + 2 =0 卡诺定理 所有工作于同温热源和同温冷源之间的热机, 其效率都不能超过可逆机(即卡诺热机),即可逆机 的效率最大。 7≤7R 所有工作于同温热源与同温冷源之间的可逆 热机,其热机效率都相等,即与热机的工作物质 无关。 10
10 2 W Q − = 1 2 1 T T = − 2 1 1 2 2 2 1 W Q Q Q Q Q Q − + = = = + 1 2 1 2 0 Q Q T T + = 1. 热机的效率 卡诺定理 I R 所有工作于同温热源和同温冷源之间的热机, 其效率都不能超过可逆机(即卡诺热机),即可逆机 的效率最大。 所有工作于同温热源与同温冷源之间的可逆 热机,其热机效率都相等,即与热机的工作物质 无关
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律.ppt
- 山东理工大学:《物理化学》课程教学大纲(F).doc
- 《物理化学》课程教学课件(PPT讲稿)课程总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学资源(书籍教材)《物理化学简明教程》倒题与习题(高等教育出版社).pdf
- 《物理化学》课程教学课件(PPT讲稿)第零章 绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)胶体 表面化学.ppt
- 《物理化学》课程教学资源(F)课件 热力学定律 热力学第一定律.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学_电解质溶液.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《分析化学》课程教学课件(PPT讲稿)分析化学中的误差.ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)沉淀滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)滴定分析法概述.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定1/2.ppt
