《分析化学》课程教学课件(PPT讲稿)滴定分析法概述

§1.6滴定分析法(titrimetry) 概述 一、 滴定分析法及其方法分类 1、滴定分析法几个基本概念 1)滴定分析法:将一种已知准 确浓度的试剂溶液(标准溶液) 滴加到待测物质的溶液中,直到 所滴加的试剂与待测物质按化学 计量关系定量反应为止,然后根 据试剂的浓度和体积,通过定量 关系计算待测物质含量的方法
1 §1.6 滴定分析法(titrimetry)概述 一、滴定分析法及其方法分类 1、滴定分析法几个基本概念 1)滴定分析法:将一种已知准 确浓度的试剂溶液(标准溶液) 滴加到待测物质的溶液中,直到 所滴加的试剂与待测物质按化学 计量关系定量反应为止,然后根 据试剂的浓度和体积,通过定量 关系计算待测物质含量的方法

2)标准溶液: 已知准确浓度的试剂溶液。 3)滴定剂: 盛装于滴定管中用于滴定分析的标准溶液。 4)滴定(titration) g 将滴定剂通过滴管滴入待测溶液中的操作过程。 滴定分析法因此而得名。 5)化学计量点(stoichiometric point,sp) 滴定剂与待测溶液按化学计量关系反应完全的 那一点(理论点)。可简称计量点(sp)
2 2)标准溶液: 已知准确浓度的试剂溶液。 3)滴定剂: 盛装于滴定管中用于滴定分析的标准溶液。 4)滴定(titration): 将滴定剂通过滴管滴入待测溶液中的操作过程。 滴定分析法因此而得名。 5)化学计量点(stoichiometric point,sp): 滴定剂与待测溶液按化学计量关系反应完全的 那一点(理论点)。可简称 计量点(sp)

6)指示剂(indicator,ln): 滴定分析中能发生颜色改变而指示终点的试剂。 7)滴定终点(end point,.ep): 滴定分析中指示剂发生颜色改变而停止滴定 的那一点(实际点)—指示剂变色点 8)滴定误差(titration error,TE) 滴定终点与化学计量点不一致造成的误差。 3
3 6)指示剂(indicator,In): 滴定分析中能发生颜色改变而指示终点的试剂。 7)滴定终点(end point,ep): 滴定分析中指示剂发生颜色改变而停止滴定 的那一点(实际点)——指示剂变色点 8)滴定误差(titration error,TE) 滴定终点与化学计量点不一致造成的误差
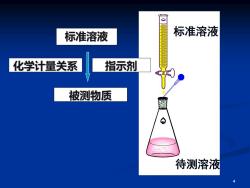
标准溶液 标准溶液 化学计量关系 指示剂 被测物质 金 待测溶液 4
4 标准溶液 化学计量关系 指示剂 被测物质 标准溶液 待测溶液

2、滴定分析法分类 1)酸碱滴定法: 以酸碱平衡为基础的滴定方法。 NaOH+HCI NaCH+H2O 2)络合滴定法:以络合平衡为基础的滴定方法。 Y4-+Ca 2+=CaY2- 3)氧化还原滴定法:以氧化还原平衡为基础的滴定方法 MnO+5Fe2++8H+=Mn2++5Fe3++8H2O 4)沉淀滴定法:利用沉淀反应进行滴定的方法。 AgNO3+NaCl=AgCI +NaNO3 5
5 2、滴定分析法分类 1)酸碱滴定法:以酸碱平衡为基础的滴定方法。 NaOH+HCl = NaCl+H2O 2)络合滴定法:以络合平衡为基础的滴定方法。 Y4-+Ca 2+ = CaY2- 3)氧化还原滴定法:以氧化还原平衡为基础的滴定方法。 MnO4 -+5Fe2++8H+ =Mn2+ +5Fe3++8H2O 4)沉淀滴定法:利用沉淀反应进行滴定的方法。 AgNO3+NaCl=AgCl ↓+NaNO3
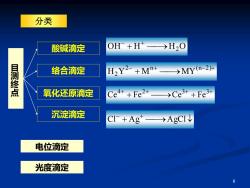
分类 酸碱滴定 OH +H >H20 目测终点 络合滴定 H2Y2+Mn+>MY(n-2)+ 氧化还原滴定 Ce4++Fe2+ →Ce3++Fe3+ 沉淀滴定 CI+Ag→AgCI 电位滴定 光度滴定 6
6 OH + H ⎯→ H 2 O − + − + ⎯→ − + + 2 n ( n 2 ) H 2 Y M MY + + + + + ⎯→ + 4 2 3 3 Ce Fe Ce Fe + ⎯→ − + Cl Ag AgCl 目测终点 酸碱滴定 络合滴定 氧化还原滴定 沉淀滴定 电位滴定 光度滴定 分类

二.滴定分析法对化学反应的要求和滴定方式 1、滴定要求: 1)反应要完全。要求达到99.99%以上 化学热力学 2)反应要迅速。—化学动力学 3)反应要定量。 (有确定的化学计量关系) 化学计量学 4)适当方法确定终点。—测定操作的要求 7
7 二.滴定分析法对化学反应的要求和滴定方式 1、滴定要求: 1)反应要完全。要求达到99.99%以上 ——化学热力学 2)反应要迅速。——化学动力学 4)适当方法确定终点。——测定操作的要求 3)反应要定量。(有确定的化学计量关系) ——化学计量学

2、方式 (1)直接滴定法 NaOH滴定HCI 例 Zn标定EDTA (2)返滴定法 适用于反应慢、没有合适指示剂的情况 先在被测试液中定量加入一种过量标准溶液,反应完全后, 再用另一种标准溶液滴定剩余的第一种标准溶液,由此测 定被测组分含量。 例: 络合滴定法测定AI EDTA +A13 、→AI-EDTA+EDTA(过量) Zn2+ +Zm一EDTA 8
8 2、方式 (1)直接滴定法 NaOH 滴定 HCl 例 Zn 标定 EDTA (2)返滴定法 例: EDTA + Al3+ ⎯ →Al − EDTA + EDTA(过量) Zn2+ Zn—EDTA nAl = nEDTA −nZn 络合滴定法测定Al 适用于反应慢、没有合适指示剂的情况 先在被测试液中定量加入一种过量标准溶液,反应完全后, 再用另一种标准溶液滴定剩余的第一种标准溶液,由此测 定被测组分含量

(3)间接滴定法 适用于不能与滴定剂直接反 应的物质。 用另外的化学反应,间接滴定生成的物质。 例: KMnO4法测定Ca Ca2++C202→CaC204↓ H H2C204 KMn0,→C02 5 nca =nc,o:=nKMno 9
9 (3)间接滴定法 例: 2 KMnO 2 2 4 H 2 4 2 2 4 2 H C O CO Ca C O CaC O ⎯⎯ ⎯4 → + ⎯→ ⎯⎯→ + + − KMnO4 法测定 Ca 4 2 2 4 Ca O KMnO 2 5 n n n C = − = 适用于不能与滴定剂直接反 应的物质。 用另外的化学反应,间接滴定生成的物质

(4)置换滴定法 不按一定反应进行或伴有副反应用此法 先用适当试剂与被测组分完全反应,使其定量置换为 另一种物质,再用标准溶液滴定生成的这种物质 例: Cr0号+S203X→无确定的计量关系 K2Cr2O 十 标定NazS2O3 61 ↓ 3×(L2+2S203→2+S402) n0=4=x2,=号s,0=n,时 nNaS2O3 =6nK,C,01 10
10 (4)置换滴定法 例: − = = = − = 2− 2 3 2 2 2 3 2 - Cr2 O7 I I S O S O 6 1 2 1 3 1 2 6 1 6 1 n n n n n Cr2 O7 2− + S2 O3 2- ⎯→ 无确定的计量关系 K2Cr2O7 标定 Na2S2O3 3 (I 2S O 2I S O ) 6I 2- 4 6 2- 2 + 2 3 ⎯→ + + − − Na2 S2 O3 K2 Cr2 O7 n = 6n 不按一定反应进行或伴有副反应用此法 先用适当试剂与被测组分完全反应,使其定量置换为 另一种物质,再用标准溶液滴定生成的这种物质
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学课件(PPT讲稿)沉淀滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)分析化学中的误差.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学_电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(F)课件 热力学定律 热力学第一定律.pdf
- 《物理化学》课程教学课件(PPT讲稿)复习总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析2/2.ppt
- 《分析化学》课程教学资源(课件讲稿,英文)Chapter 2 Errors and data treatment in quantitative analysis.pdf
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 4 Acid-base equilibria.ppt
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 6 Oxidation-reduction titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)绪论 Analytical chemistry(化学分析部分).ppt
- 《分析化学》课程各章 思考题(含答案)第七章.doc
- 《分析化学》课程各章 思考题(含答案)第九章.doc
- 《分析化学》课程各章 思考题(含答案)第八章.doc
- 《分析化学》课程各章 思考题(含答案)第十章.doc
- 《分析化学》课程教学资源(各章知识点)第六章 配位滴定法、第七章 氧化还原滴定法、第八章 沉淀滴定法.doc
- 《分析化学》课程教学资源(各章知识点)第一章 概论、第三章 误差及数据处理、第五章 酸碱滴定法.doc
- 《高分子化学实验》课程实验指导(讲义)实验五 聚丙烯腈的部分水解反应.doc
- 《高分子化学实验》课程实验指导(讲义)实验四 三聚氰胺甲醛树脂的合成及层压板的制备.doc
- 《高分子化学实验》课程实验指导(讲义)实验五 本体聚合MMA及其透光率测定.doc
- 《高分子化学实验》课程实验指导(讲义)实验二 丙烯酰胺溶液聚合及其干燥加工.doc
- 《高分子化学实验》课程实验指导(讲义)实验四 醋酸乙烯酯的乳液聚合及固含量测定.doc
