陕西科技大学:《有机化学》课程教学资源(PPT课件)第七章 波谱分析(5.4)紫外光谱(Ultra Voilet Spectroscopy)

(四)紫外光谱 (Ultra Voilet Spectroscopy) (1)紫外光谱图 (2)基本原理 (3)UV图谱的解析
(四 ) 紫外光谱 (Ultra Voilet Spectroscopy) (1) 紫外光谱图 (2) 基本原理 (3) UV图谱的解析

(四)紫外光谱 (Ultra Voilet Spectroscopy) 紫外光谱的产生是由于有机分子在入射光的 作用下,发生了价电子的跃迁,使分子中的价 电子由基态E跃迁到激发态E,。 。 分子的结构不同,跃迁电子的能级差不同,从 而分子UV吸收的max不同;另外,发生各种 电子跃迁的机率也不同,反映在紫外吸收上为 emax不同。 。 因而可根据max和smax了解一些分子结构的信 息
(四 ) 紫外光谱 (Ultra Voilet Spectroscopy) • 紫外光谱的产生是由于有机分子在入射光的 作用下,发生了价电子的跃迁,使分子中的价 电子由基态E0跃迁到激发态E!。 • 分子的结构不同,跃迁电子的能级差不同,从 而分子UV吸收的λmax不同;另外,发生各种 电子跃迁的机率也不同,反映在紫外吸收上为 εmax不同。 • 因而可根据λmax和εmax了解一些分子结构的信 息
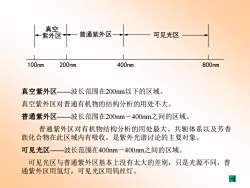
真空 紫最 普通紫外区一 可见光区 100nm 200nm 400nm 800nm 真空紫外区一波长范围在200nm以下的区域。 真空紫外区对普通有机物的结构分析的用处不大。 普通紫外区一波长范围在200nm-400nm之间的区域。 普通紫外区对有机物结构分析的用处最大。共轭体系以及芳香 族化合物在此区域内有吸收,是紫外光谱讨论的主要对象。 可见光区—波长范围在400nm一400nm之间的区域。 可见光区与普通紫外区基本上没有太大的差别,只是光源不同,普 通紫外区用氢灯,可见光区用钨丝灯。 国
普通紫外区 真空 紫外区 可见光区 100nm 200nm 400nm 800nm 真空紫外区——波长范围在200nm以下的区域。 真空紫外区对普通有机物的结构分析的用处不大。 普通紫外区——波长范围在200nm-400nm之间的区域。 普通紫外区对有机物结构分析的用处最大。共轭体系以及芳香 族化合物在此区域内有吸收,是紫外光谱讨论的主要对象。 可见光区——波长范围在400nm-400nm之间的区域。 可见光区与普通紫外区基本上没有太大的差别,只是光源不同,普 通紫外区用氢灯,可见光区用钨丝灯
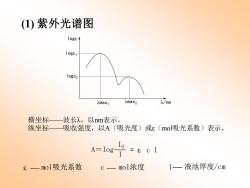
(1)紫外光谱图 logs logE1 logs2 Amax1 入max2 )/nm 横坐标 波长),以nm表示。 纵坐标 吸收强度,以A(吸光度)或ε(mol吸光系数)表示。 A=10g-I 8一mol吸光系数 C— mol浓度 1一液池厚度/cm
(1) 紫外光谱图 l/nm loge loge1 loge2 lmax1 lmax2 横坐标——波长λ,以nm表示。 纵坐标——吸收强度,以A(吸光度)或ε(mol吸光系数)表示。 e mol吸光系数 c mol浓度 l 液池厚度/cm A=log I I0 = e c l

当电子发生跃迁时,不可避免地要伴随着分子振、转能 级的改变,加之溶剂的作用,一般UV谱图不会呈现尖 锐的吸收峰,而是一些胖胖的平滑的峰包。在识别谱图 时,以峰顶对应的最大吸收波长入max和最大摩尔吸收系 数cmax为准。 有机化合物UV吸收的max和emax在不同溶剂中略有 差异。因此,有机物的UV吸收谱图应标明所使用的溶 剂
当电子发生跃迁时,不可避免地要伴随着分子振、转能 级的改变,加之溶剂的作用,一般UV谱图不会呈现尖 锐的吸收峰,而是一些胖胖的平滑的峰包。在识别谱图 时,以峰顶对应的最大吸收波长λmax和最大摩尔吸收系 数εmax为准。 有机化合物UV吸收的λmax和εmax在不同溶剂中略有 差异。因此,有机物的UV吸收谱图应标明所使用的溶 剂

(2)UV基本原理 (甲)UV光谱的产生 (乙)UV术语 (丙)UV吸收带及其特征 (i)R带[来自德文Radikalartig(基团)] ()K带来自德文Konjugierte(共轭)] (iiB带[来自德文Benzienoid(苯系)]和E带[来 自德文Ethylenic(乙烯型)] 国
(2) UV基本原理 (甲) UV光谱的产生 (乙) UV术语 (丙) UV吸收带及其特征 (i) R带[来自德文Radikalartig(基团)] (ii) K带[来自德文Konjugierte(共轭)] (iii) B带[来自德文Benzienoid(苯系)]和E带[来 自德文Ethylenic(乙烯型)]
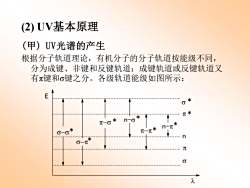
(2)UV基本原理 (甲)UV光谱的产生 根据分子轨道理论,有机分子的分子轨道按能级不同, 分为成键、非键和反键轨道;成键轨道或反键轨道又 有π键和σ键之分。各级轨道能级如图所示: 0米 元米 米 -6 元
(2) UV基本原理 (甲) UV光谱的产生 根据分子轨道理论,有机分子的分子轨道按能级不同, 分为成键、非键和反键轨道;成键轨道或反键轨道又 有π键和σ键之分。各级轨道能级如图所示: n s p p * * s E l n-p* p-p* s-s* s-p* n-s* p-s *

通常有机分子处于基态,电子填入成键或非键轨道。 但有机分子吸收UV后,则受激变为激发态,电子进入反 键轨道。 由图可知:可能的电子跃迁有6种。但实际上,由跃 迁能级差和跃迁选律所决定,几乎所有的UV吸收光谱都 是由π一π*跃迁或-π*跃迁所产生的,且n-π*跃迁一般 都是弱吸收(ε<100)
通常有机分子处于基态,电子填入成键或非键轨道。 但有机分子吸收UV后,则受激变为激发态,电子进入反 键轨道。 由图可知:可能的电子跃迁有6种。但实际上,由跃 迁能级差和跃迁选律所决定,几乎所有的UV吸收光谱都 是由π-π*跃迁或n-π*跃迁所产生的,且n-π*跃迁一般 都是弱吸收(ε<100)

(乙)UV术语 (a)发色团 引起电子跃迁的不饱和基团。一般为带有π电子的基团例 如: >0、00、N、w、8-0.@ 等 由于不同的有机分子所含有的发色团不同,组成它们的 分子轨道不同,能级不同,发生价电子跃迁的能量不同, 故max是UV用于结构分析的主要依据
(乙) UV术语 (a) 发色团 引起电子跃迁的不饱和基团。一般为带有π电子的基团例 如 : C=C C=O C=N- -N=N- -N O O 、 、 、 、 、 等 由于不同的有机分子所含有的发色团不同,组成它们的 分子轨道不同,能级不同,发生价电子跃迁的能量不同, 故λmax是UV用于结构分析的主要依据

(b)助色团 本身并无近紫外吸收,但与发色团相连时,常常要影响 max和max的基团。例如: KD B带:2max255nm(ε230) CI B带:1max264nm(e190) -0H B带:max270nm(e1450) -NH2B带:2ma×280nm(e1430) 特点:助色团一般是带有p电子的基团。例如: -OH、-NH2、-OR、-NR2、-SR、-X等
(b) 助色团 本身并无近紫外吸收,但与发色团相连时,常常要影响 λmax和εmax的基团。例如: OH B带:lmax 255nm( e 230) B带:lmax 270nm( e 1450) Cl B带:lmax 264nm( e 190) NH2 B带:lmax 280nm( e 1430) 特点:助色团一般是带有p电子的基团。例如: -OH 、-NH2 、 -OR 、-NR2 、-SR 、-X 等
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第七章 波谱分析(5.3)核磁共振.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第七章 波谱分析(5.1-5.2,2/2).ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第七章 波谱分析(5.1-5.2,1/2).ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第六章 脂环烃.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第五章 对映异构.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第三章 不饱和烃(3.6)烯烃和炔烃的工业来源和制法.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第三章 不饱和烃(3.5)烯烃和炔烃的化学性质(2/2).ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第三章 不饱和烃(3.5)烯烃和炔烃的化学性质(1/2).ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第二章 饱和烃(烷烃).ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十七章 萜类和甾体化合物.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十六章 糖类化合物.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十五章 周环反应.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十四章 杂环化合物.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十三章 有机含氮化合物.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十一章 羧酸和取代羧酸.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十章 酚和醌.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第九章 羰基化合物.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第八章 芳烃.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第七章 炔烃和二烯烃.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第六章 烯烃.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第七章 波谱分析(5.5)质谱(Mass Specrometry).ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第八章 脂肪族卤代烃.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第九章 醇和醚.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十章 芳烃、芳香性.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十一章 芳卤化合物和芳磺酸.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十二章 酚和醌.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十三章 醛和酮.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十四章 羧酸.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十五章 羧酸衍生物.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十六章 β-二羰基化合物和有机合成.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十七章 有机含氮化合物.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十九章 碳水化合物.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第二十章 氨基酸和蛋白质(1/2).ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第二十章 氨基酸和蛋白质(2/2).ppt
- 《生物化学》课程教学资源(书籍教材)生物化学PDF电子版(上,编著:沈同、王镜岩,第1-9章).pdf
- 《生物化学》课程教学资源(书籍教材)生物化学PDF电子版(下,编著:沈同、王镜岩,第1-23章).pdf
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第一章 蛋白质的结构和功能.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第三章 酶 学.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第五章 糖代谢.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第六章 脂类代谢.ppt
