内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十一章 化学动力学基础(一)
物理化学电子教案—第十一章 积分法 微分法 半衰期法 孤立法 化学动力学基础(一) 一级反应对峙反应 平行反应 连续反应链反应 4上一内容 下一内容 ◇回主目录 ←返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 物理化学电子教案— 第十一章 积分法 微分法 半衰期法 孤立法 一级反应 对峙反应 平行反应 连续反应 链反应

第十一章化学动力学基础(一) ◆化学动力学的任务和且的 ◆化学反应速率表示法 ◆化学反应的速率方程 ◆具有简单级数的反应 ◆几种典型的复杂反应 ◆温度对反应速率的影响 ◆活化能对反应速率的影响 ◆链反应 ◆拟定反应历程的一般方法 上一内容 下一内容 ◇回主目录 ←返回 2009-62
上一内容 下一内容 回主目录 返回 2009-6-2 化学动力学的任务和目的 第十一章 化学动力学基础(一) 化学反应速率表示法 拟定反应历程的一般方法 化学反应的速率方程 具有简单级数的反应 几种典型的复杂反应 温度对反应速率的影响 活化能对反应速率的影响 链反应

化学动力学的任务和目的 化学热力学的研究对象和局限性 研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如: △,G7/kJ.mol N,+3H,→NH,g) -16.63 H2+ -02 —→H20(I) -237.19 热力学只能判断这两个反应都能发生,但如何使它发 生,热力学无法回答。 4上一内容 下一内容 ◇回主目录 ←返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 化学动力学的任务和目的 研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如: 2 2 3 2 2 2 1 3 N H NH (g) 2 2 1 H O H O(l) 2 热力学只能判断这两个反应都能发生,但如何使它发 生,热力学无法回答。 化学热力学的研究对象和局限性 237.19 16.63 / kJ mol 1 rGm

化学动力学的任务和目的 化学动力学的研究对象 化学动力学研究化学反应的速率和反应的机理以及 温度、压力、催化剂、溶剂和光照等外界因素对反应 速率的影响,把热力学的反应可能性变为现实性。 例如: 动力学认为: N,+H,→H,g) 3 需一定的T,p和催化剂 H2+02→H20) 点火,加温或催化剂 4上一内容 ·下一内容 ◇回主目录 ←返回 2009-62
上一内容 下一内容 回主目录 返回 2009-6-2 化学动力学的任务和目的 化学动力学研究化学反应的速率和反应的机理以及 温度、压力、催化剂、溶剂和光照等外界因素对反应 速率的影响,把热力学的反应可能性变为现实性。 化学动力学的研究对象 2 2 3 2 2 2 1 3 N H NH (g) 2 2 1 H O H O(l) 2 例如: 动力学认为: 需一定的T,p和催化剂 点火,加温或催化剂

化学动力学的任务和目的 化学动力学发展简史 •1848年 dlnK。 AU dlnk Ea van't Hoff dT RT2 dT RT2 K。 提出: k 1891年 Arrhenius k=Aexp(-) RT 设E,为与T无关的常数 1935年 Eyring?等提出过渡态理论 1960年 交叉分子束反应,李远哲等人1986年 获诺贝尔化学奖 上一内容 下一内容 ◇回主目录 ←返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 化学动力学的任务和目的 •1848年 van’t Hoff 提出: b f c k k K •1891年 Arrhenius a exp( ) E k A RT 设Ea为与T无关的常数 •1935年 Eyring等提出过渡态理论 •1960年 交叉分子束反应,李远哲等人1986年 获诺贝尔化学奖 化学动力学发展简史 2 2 c dln d d ln RT E dT k RT U T K a

反应速度和速率 速度 Velocity 是矢量,有方向性。 速率 Rate 是标量,无方向性,都是正值。 例如: R→P 速度 dR]0 dt dt 速率 -d[R]d[P] >0 dt dr 4上一内容 ·下一内容 ◇回主目录 ←返回 2009-62
上一内容 下一内容 回主目录 返回 2009-6-2 反应速度和速率 速度 Velocity 是矢量,有方向性。 速率 Rate 是标量 ,无方向性,都是正值。 d[R] d[P] 0 0 d d t t 速度 d[R] d[P] 0 d d t t 速率 例如: R P

平均速率 平均速率 R (R]2-[R]1) [P2] [R] t2-t1 [P:] [R2] 万= ([P]2-[P]) t2-t1 它不能确切反映速率的变 化情况,只提供了一个平 均值,用处不大。 4上一内容 下一内容 ◇回主目录 ←返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 平均速率 2 1 2 1 p 2 1 2 1 R ([P] [P] ) ([R] [R] ) t t r t t r 它不能确切反映速率的变 化情况,只提供了一个平 均值,用处不大

平均速率 平均速率 R [P2] [R] [P:] [R2] h t 4上一内容 ·下一内容 ◇回主目录 ←返回 2009-62
上一内容 下一内容 回主目录 返回 2009-6-2 平均速率
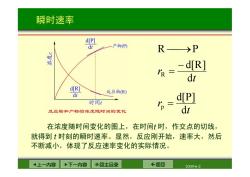
瞬时速率 d[P] dr 一产物P) R→P - d[R] IR= dt d[R] 反应物(R) dt d[P] 时间1 p= 反应物和产物的浓度随时间的变化 dr 在浓度随时间变化的图上,在时间t时,作交点的切线, 就得到t时刻的瞬时速率。显然,反应刚开始,速率大,然后 不断减小,体现了反应速率变化的实际情况。 4上一内容 下一内容 ◇回主目录 ←返回 2009-6-2
上一内容 下一内容 回主目录 返回 2009-6-2 瞬时速率 t r t r d d[P] d d[R] R P p R 在浓度随时间变化的图上,在时间t 时,作交点的切线, 就得到 t 时刻的瞬时速率。显然,反应刚开始,速率大,然后 不断减小,体现了反应速率变化的实际情况

瞬时速率 d[P] dt 一产物P) d[R] 反应物(R) dt 时间 反应物和产物的浓度随时间的变化 上一内容 ·下一内容 ◇回主目录 ←返回 2009-62
上一内容 下一内容 回主目录 返回 2009-6-2 瞬时速率
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十一章 化学动力学基础(二).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第三章 热力学第二定律.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第七章 电化学.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第六章 相平衡.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十章 界面现象.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第五章 化学平衡.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第十二章 羧酸及其衍生物.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第四章 溶液(Solution).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第二章 热力学第一定律及其应用 The First Law Of Thermodynamics.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第一章 气体的性质(properties of gases).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)绪论.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第十章 醇、酚、醚.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第十一章 醛、酮.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第九章 卤代烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第七章 芳烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第二章 饱和烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第一章 绪论.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第四章 烯烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第五章 炔烃和二烯烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第八章 吸光光度法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十三章 胶体分散体系和大分子溶液.pdf
- 《分析化学》课程教学课件(PPT讲稿)第十章 分光光度法.ppt
- 《分析化学》课程教学资源(课件讲稿)第九章 重量分析法.pdf
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 络合滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 误差与数据处理.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程课后思考题(含答案)第六章.doc
- 《分析化学》课程课后思考题(含答案)第三章.doc
- 《分析化学》课程课后思考题(含答案)第一章.doc
- 《分析化学》课程教学资源(国家标准)GB-T 8170-2008 数值修约规则与极限数值的表示和判定.pdf
- 《物理化学》课程教学课件(PPT讲稿)总复习.ppt
- 《物理化学》课程教学资源(课堂小测验与解答).doc
- 《有机与药物合成化学》课程教学课件(讲稿)有机化合物官能团引入与碳链增长——含碳氢氧卤素化合物的一般合成(山东科技大学:王鹏).pdf
- 《有机与药物合成化学》课程教学课件(讲稿)杂环化合物.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)杂元素化合物——含杂元素的有机物.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)含氮化合物——有机氮的性质.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)β-二羰基化合物——活泼亚甲基的反应.ppt
