内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第五章 化学平衡

第五章 北学平衡 本章目录 5.1化学反应等温方程 5.2理想气体化学反应的标准平衡常数 5.3温度对标准平衡常熟的影响 5.4其他常数对理想气体化学平衡的影响 5.6真实气体反应的化学平衡 5.7混合物和溶液的化学平衡 7c1 上页 下页 回主目最 返回 2009年6月2日
2009年6月2日 第五章 化学平衡 本章目录 5.1 化学反应等温方程 5.2 理想气体化学反应的标准平衡常数 5.3 温度对标准平衡常熟的影响 5.4 其他常数对理想气体化学平衡的影响 5.6 真实气体反应的化学平衡 5.7 混合物和溶液的化学平衡

§5,1化学反寇的等温方程 本节要目 1。摩尔反应Gibbs函数与化学反应亲和势 2。摩尔反应Gibbsi函数与反应进度的关系, 平衡条件 mikCy 3。化学反应等温方程试 P097c0Gm10 上页 下页 回王目最 返回 2009年6月2日
2009年6月2日 §5.1化学反应的等温方程 本节要目 1。摩尔反应Gibbs函数与化学反应亲和势 2。摩尔反应Gibbs函数与反应进度的关系, 平衡条件 3。化学反应等温方程试

反寇的摩尔吉布斯能变多化学反定票和梦 化学反应体系: 封闭的单相体系,不作非膨胀功,发生了一个 化学反应,设为: dD+eE+.→fF+gG+. 在体系内发生了微小的变化(包括温度、压力和化学反应的变 化),体系内各物质的量相应地有微小的变化(设无非体积 功),则 dG=-SdT+VdP+∑adn dG=∑u,h, 如果变化是在等工,P进行的,则 本Gm-<0 上页 下页 回主目最 返回 2009年6月2日
2009年6月2日 1. 反应的摩尔吉布斯能变与化学反应亲和势 化学反应体系: 封闭的单相体系,不作非膨胀功,发生了一个 化学反应,设为: 在体系内发生了微小的变化(包括温度、压力和化学反应的变 化),体系内各物质的量相应地有微小的变化(设无非体积 功),则 如果变化是在等T, P进行的,则 d e f g D E F G dG= -SdT+VdP+ B B dn B dG= B B B dn rGm=<0

§5.1反丞的等温方翟 亲和势(affinity) 1922年,比利时热力学专家德唐德(De donder)首先引进了化学 反应亲和势的概念。他定义化学亲和势A为 def p=- B A是状态函数,体系的强度性质。相当于化学反应的推动力。 用A判断化学反应的方向具有“势”的性质,即: A>0 反应正向进行 A=0 反应达平衡 A<0 反应逆向进行 上页 下页 回王目最 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程 亲和势(affinity) 1922年,比利时热力学专家德唐德(De donder)首先引进了化学 反应亲和势的概念。他定义化学亲和势A为 def , B B B ( )T p G A A是状态函数,体系的强度性质。相当于化学反应的推动力。 用A判断化学反应的方向具有“势”的性质,即: A>0 反应正向进行 A=0 反应达平衡 A<0 反应逆向进行 =- rGm

2。序你反寇从品教与反寇建意的吴康,平衡条件 根据反应进度的定义,可以得到: dξ= dne dng-VgdE (dG)z.p=∑edne=∑Vged5 (dng =vade) 对于为微小变化或为1mo1时体系的吉布斯能的改变为: G og T P 上页 下页 回主目最 返回 2009年6月2日
2009年6月2日 2。摩尔反应Gibbs函数与反应进度的关系,平衡条件 根据反应进度的定义,可以得到: 对于为微小变化或为1mol时体系的吉布斯能的改变为: B B d d n B B dn =νdξ , B B B B B B d d d ( )G n T p B B (d d ) n , r m B B T P G G

§5.1反丞的等温方翟 公式理解: a)在一个无限量的体系内,体系的发生一个mo变化引起G的变化 b) 在一个有限量的体系内,体系发生一个微小变化d引起体系发 生一个dG的变化。 对△,Gm的理解: 1)量纲:J.mo1 2)强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4) 随着反应的进行,由于浓度发生变化,则发生变化,引起变 化,所以不是一个定值。 上页 下页 回王目最 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程 公式理解: a) 在一个无限量的体系内,体系的发生一个mol变化引起G的变化 b) 在一个有限量的体系内,体系发生一个微小变化d ,引起体系发 生一个dG的变化。 对 的理解: 1)量纲:J.mol-1 2) 强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4)随着反应的进行,由于浓度发生变化,则B发生变化,引起变 化,所以不是一个定值。 r m G

§5.1反爱的等温方程 多相反应若各相组成恒定如: A(s)=B(g)+C(g), +RTIn (P/P 各组分化学势与反应进度无关,摩尔Gibbs函数 也与无关.即系统的G为一直线。其斜率△G 为负,A>0,正向反应可以自发进行,一直到 底; 为零,A=0, 处于化学平衡; 为正,A<0 正向反应不可能进行。 上页 下页 回主目最 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程 多相反应若各相组成恒定如: A(s)===B(g)+C(g), B =B ⊝ +RTln(PB /P ⊝ ) 各组分化学势与反应进度无关,摩尔Gibbs函数 也与无关. 即系统的G-为一直线。其斜率r Gm 为负,A>0, 正向反应可以自发进行,一直到 底; 为零,A=0, 处于化学平衡; 为正,A<0 正向反应不可能进行。 G
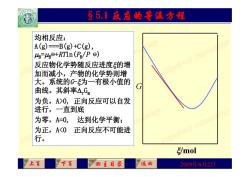
§5.1反丞的等温方翟 均相反应: A(g)==B(g)+C(g), uB-uge+RTIn(P/P 反应物化学势随反应进度的增 加而减小,产物的化学势则增 大。系统的G为一有极小值的 曲线。其斜率△Gn G 为负,A>0,正向反应可以自发 进行,一直到底 为零,A=0, 达到化学平衡; 为正,A<0 正向反应不可能进 行。 /mol 上页 下页 回王目最 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程 均相反应: A(g)===B(g)+C(g), B =B ⊝ +RTln(PB/P ⊝ ) 反应物化学势随反应进度的增 加而减小,产物的化学势则增 大。系统的G-为一有极小值的 曲线。其斜率rGm 为负,A>0, 正向反应可以自发 进行,一直到底 为零,A=0, 达到化学平衡; 为正,A<0 正向反应不可能进 行。 G mol

§5,1反爱的等温方程 G ● 用 判断,这相当于G-5图上曲线的斜率,因为是微小变 化, 反应进度处于0~1mol之间。 0 T.P 反应自发向左进 行,趋向平衡 =0 反应达到平衡 上页 下页 回主目录 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程 • 用 判断,这相当于G - 图上曲线的斜率,因为是微小变 化,反应进度处于0~1 mol之间。 T P, G ( ) , 0 T p G 反应自发向右进 行,趋向平衡 ( ) , 0 T p G 反应自发向左进 行,趋向平衡 ( ) , 0 T p G 反应达到平衡

§5.1反丞的等温方翟 0 2次caem2 G 0 5- uiecl elemig 体条的吉布斯自由能和的关系 上页 下页 回王目最 返回 2009年6月2日
2009年6月2日 §5.1 反应的等温方程
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第十二章 羧酸及其衍生物.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第四章 溶液(Solution).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第二章 热力学第一定律及其应用 The First Law Of Thermodynamics.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第一章 气体的性质(properties of gases).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)绪论.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第十章 醇、酚、醚.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第十一章 醛、酮.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第九章 卤代烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第七章 芳烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第二章 饱和烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第一章 绪论.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第四章 烯烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第五章 炔烃和二烯烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第八章 吸光光度法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第五章 配位滴定法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第六章 氧化还原滴定法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第七章 沉淀滴定法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第四章 酸碱滴定法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第三章 滴定分析.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第二章 误差及分析数据的统计处理.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十章 界面现象.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第六章 相平衡.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第七章 电化学.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第三章 热力学第二定律.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十一章 化学动力学基础(二).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十一章 化学动力学基础(一).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十三章 胶体分散体系和大分子溶液.pdf
- 《分析化学》课程教学课件(PPT讲稿)第十章 分光光度法.ppt
- 《分析化学》课程教学资源(课件讲稿)第九章 重量分析法.pdf
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 络合滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 误差与数据处理.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程课后思考题(含答案)第六章.doc
- 《分析化学》课程课后思考题(含答案)第三章.doc
- 《分析化学》课程课后思考题(含答案)第一章.doc
- 《分析化学》课程教学资源(国家标准)GB-T 8170-2008 数值修约规则与极限数值的表示和判定.pdf
- 《物理化学》课程教学课件(PPT讲稿)总复习.ppt
