内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第一章 气体的性质(properties of gases)

第一章气体的性质 properties of gases 要求:了解理想气体真实气体模型; 由理想到真实的修正方法。 掌握:理想气体状态方程;分压定律 作业:p30 1.7 1.11
第一章 气体的性质 (properties of gases) 要求:了解理想气体真实气体模型; 由理想到真实的修正方法。 掌握:理想气体状态方程;分压定律 作业:p30 1.7 1.11

第一章气体的性质 properties of gases l-1理想气体(Ideal gas or perfect gas l.理想气体状态方程(State equation of ideal gas) Boyle's law:(constart n,T) =nRT Charles's law:I oc T (constant n,P) Avogadro's law:I oc n (constant P,T) PVn=RT nT D V=R P R=8.314J mol-iK-
第一章 气体的性质 (properties of gases) 1-1 理想气体(Ideal gas or perfect gas) 1. 理想气体状态方程(State equation of ideal gas) pV RT pV nRT m R=8.314J·mol-1·K-1
理想气体模型 Model of ideal gas 分子间无相互作用 分子为刚性质点 高温低压气体
r E 0 理想气体模型 Model of ideal gas 分子间无相互作用 分子为刚性质点 高温低压气体

1-2理想气体混合物 Mixture of deal gas perfect gas 1混合物的组成(Mixture composition) def XB nB ∑nB mB WB mB B B /B=xB'm.B ∑(xB'm.B )-XB B B
1-2 理想气体混合物 (Mixture of deal gas / perfect gas) 1 混合物的组成(Mixture composition) xB == wB == B == def B B m B B m B B B B B B B B B B V V x V x V m m n n ( ) , , =xB

2、分压和道尔顿分压定律 Partial pressure and Dolton's law of partial pressure) Define: 在气体混合物中 PB=卫·XB PB 气体B的分压 P混合气体的总压 XB 气体B在混合气中的摩尔分数 此定义既适用于理想气体也适用于实际气体 p=∑p B
2、分压和道尔顿分压定律 (Partial pressure and Dolton’s law of partial pressure) Define: 在气体混合物中 B B p px pB : 气体B的分压 p: 混合气体的总压 xB : 气体B在混合气中的摩尔分数 B p p B 此定义既适用于理想气体也适用于实际气体
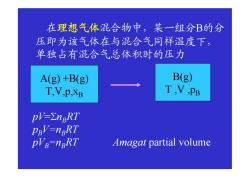
在理想气体混合物中,某一组分B的分 压即为该气体在与混合气同样温度下, 单独占有混合气总体积时的压力 A(g)+B(g) B(g) T,V,p.XB T,V,PB pV-EnpRT PBV=nERT PVE-nBRT Amagat partial volume
在理想气体混合物中,某一组分B的分 压即为该气体在与混合气同样温度下, 单独占有混合气总体积时的压力 A(g) +B(g) T,V,p,xB B(g) T ,V ,pB pV=nBRT pBV=nBRT pVB =nBRT Amagat partial volume
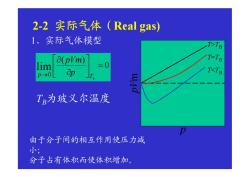
2-2实际气体(Real gas) 1、实际气体模型 T>T8 a(pVm) T=TB =0 ap T<TB TB为玻义尔温度 由于分子间的相互作用使压力减 小 分子占有体积而使体积增加
2-2 实际气体(Real gas) 1、实际气体模型 由于分子间的相互作用使压力减 小; 分子占有体积而使体积增加。 TB为玻义尔温度 T>TB T=TB T<TB p Vm p 0 ( ) lim 0 TB p p pVm

2-2实际气体(Real gas) 2、实际气体的状态方程 1 van der Waals equation (p+日XC-D=RI (2)R-K equation (Redlich and kwong [p+ a 化+b)pTa KV-b)=RT m
2-2 实际气体(Real gas) 2、实际气体的状态方程 (1)van der Waals equation ( )( ) 2 V b RT V a p m m (2) R - K equation (Redlich and kwong) ( ) ( ) 1/ 2 V b RT V b V T a p m m m

(3)Virial equation B2 B3 +)》 RT pV RT 2=(1+B2'p+B'p2+.) B::virial coefficient
(3) Virial equation (1 ' ' ) (1 ) 2 2 3 2 2 3 B p B p RT pV V B V B RT pV m m m m Bi : virial coefficient
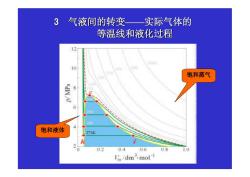
3气液间的转变一 实际气体的 等温线和液化过程 12 1 饱和蒸气 edW/d 饱和液体 27 2 0 0.2 0.4 06 0.8 10 Im/dm3.mol
3 气液间的转变— — 实际气体的 等温线和液化过程 饱和液体 饱和蒸气
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)绪论.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第十章 醇、酚、醚.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第十一章 醛、酮.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第九章 卤代烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第七章 芳烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第二章 饱和烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第一章 绪论.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第四章 烯烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第五章 炔烃和二烯烃.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第八章 吸光光度法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第五章 配位滴定法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第六章 氧化还原滴定法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第七章 沉淀滴定法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第四章 酸碱滴定法.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第三章 滴定分析.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第二章 误差及分析数据的统计处理.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(无机化学讲稿)第十三章 过渡元素.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(分析化学讲稿)第一章 序论.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(无机化学讲稿)第十二章 氮族、碳族和硼族元素.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(无机化学讲稿)第十一章 卤素和氧族元素.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第二章 热力学第一定律及其应用 The First Law Of Thermodynamics.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第四章 溶液(Solution).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(有机化学讲稿)第十二章 羧酸及其衍生物.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第五章 化学平衡.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十章 界面现象.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第六章 相平衡.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第七章 电化学.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第三章 热力学第二定律.pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十一章 化学动力学基础(二).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十一章 化学动力学基础(一).pdf
- 内蒙古科技大学:《基础化学》课程教学课件(物理化学讲稿)第十三章 胶体分散体系和大分子溶液.pdf
- 《分析化学》课程教学课件(PPT讲稿)第十章 分光光度法.ppt
- 《分析化学》课程教学资源(课件讲稿)第九章 重量分析法.pdf
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 络合滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 误差与数据处理.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程课后思考题(含答案)第六章.doc
