河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十八章 非金属元素小结

第十八章 非金属元素小结 18-1非金属单质的结构和性质 18-2分子型氢化物 18-3含氧酸 18-4 非金属含氧酸盐的某些性质 18-5 p区元素的次级周期性
第十八章 非金属元素小结 ⚫ 18-1 非金属单质的结构和性质 ⚫ 18-2 分子型氢化物 ⚫ 18-3 含氧酸 ⚫ 18-4 非金属含氧酸盐的某些性质 ⚫ 18-5 p区元素的次级周期性

18-1非金属单质的结构和性质 18-1-1非金属单质的结构和物理性质 非金属单质的结构多数为分子晶体,少数为 原子晶体和层状晶体,分子中的原子大都是以二 中心二电子共价键相结合的。可以分为三类: 第一类为小分子组成的单质,如稀有气体和卤素 熔点沸点较低。 第二类为多原子分子组成的单质,通常为固体, 容沸点也不高,但比第一类高。 第三类为大分子单质,如金刚石,晶态硅和单质 硼,熔点,沸点极高,难挥发
18-1 非金属单质的结构和性质 18-1-1 非金属单质的结构和物理性质 非金属单质的结构多数为分子晶体,少数为 原子晶体和层状晶体,分子中的原子大都是以二 中心二电子共价键相结合的。可以分为三类: 第一类为小分子组成的单质,如稀有气体和卤素, 熔点沸点较低。 第二类为多原子分子组成的单质,通常为固体, 容沸点也不高,但比第一类高。 第三类为大分子单质,如金刚石,晶态硅和单质 硼,熔点,沸点极高,难挥发

白磷的结构 红磷的结构 硼的结构 黑磷的结构
白磷的结构 红磷的结构 黑磷的结构 硼的结构

18-1-2 非金属单质的化学反应 活泼的非金属容易与金属元素形成卤化物、 氧化物、硫化物、氢化物或含氧酸盐等等。非 金属元素彼此之间也可以形成卤化物、氧化物、 氮化物、无氧酸和含氧酸等。绝大部分非金属 氧化物显酸性,能与强碱作用。准金属的氧化 物既与强酸又与强碱作用而显两性。大部分非 金属单质不与水作用,卤素仅部分地与水反应, 碳、磷、硫、碘等被浓硝或浓硫酸所氧化。有 不少非金属单质在碱性水溶液中发生歧化反应, 或者与强碱反应,但非歧化反应
18-1-2 非金属单质的化学反应 活泼的非金属容易与金属元素形成卤化物、 氧化物、硫化物、氢化物或含氧酸盐等等。非 金属元素彼此之间也可以形成卤化物、氧化物、 氮化物、无氧酸和含氧酸等。绝大部分非金属 氧化物显酸性,能与强碱作用。准金属的氧化 物既与强酸又与强碱作用而显两性。大部分非 金属单质不与水作用,卤素仅部分地与水反应, 碳、磷、硫、碘等被浓硝或浓硫酸所氧化。有 不少非金属单质在碱性水溶液中发生歧化反应, 或者与强碱反应,但非歧化反应

18-2 分子型氢化物 18-2.1稳定性 稳定性与组成氢化物的非金属元素的电负性(x)有关。 非金属与氢的电负性相差越远,所生成的氢化物越稳定; 反之,不稳定。AsH很不稳定,它不能由As与H2直接合 成而F很稳定,加热至高温也不会分解。 分子型氢化物的标准生成自由能△,G或标准生成焓 △H越负,氢化物越稳定。 在同一周期中,从左到右逐渐增加,在同一族中,自 上而下地减小。这个变化规律与非金属元素电负性的变化 规律是一致的。在同一族中,分子型氢化物的热稳定性与 键强自上而下越来越弱有关
18-2 分子型氢化物 18-2-1 稳定性 稳定性与组成氢化物的非金属元素的电负性(χA )有关。 非金属与氢的电负性相差越远,所生成的氢化物越稳定; 反之,不稳定。AsH3很不稳定,它不能由As与H2直接合 成而HF很稳定,加热至高温也不会分解。 分子型氢化物的标准生成自由能ΔfG0或标准生成焓 ΔfH0越负,氢化物越稳定。 在同一周期中,从左到右逐渐增加,在同一族中,自 上而下地减小。这个变化规律与非金属元素电负性的变化 规律是一致的。在同一族中,分子型氢化物的热稳定性与 键强自上而下越来越弱有关

1822还原性 (1)与02的反应 4NH,+50,=4NO+6H,O (2)与C2的反应 H,S+CI,=2HCI+S 2HBr+C1,=2HCI+Br (3)与金属离子M的反应 2ASH+12Ag*+3H,O=As,O3+12Ag+12H H,S+2Fe3+=S+2Fe2++2H+ (4)与含氧酸盐的反应 5H,S+2MnO+6H*=2Mn2++5S+8H,O
18-2-2 还原性 (1)与O2的反应 4NH3+5O2 =4NO+6H2O (2)与Cl2的反应 H2 S+Cl2 =2HCl+S 2HBr+C12 =2HCI+Br (3) 与金属离子M+ 的反应 2AsH3+12Ag++3H2O=As2O3+12Ag+12H+ H2 S+2Fe3+=S+2Fe2++ 2H+ (4) 与含氧酸盐的反应 5H2 S+2MnO4 -+6H+=2Mn2++5S+8H2O

81823水溶液的酸碱性和无氧酸的强度 影响氢化物在水中的酸碱性,主要因素各两个:HA的键能和非全 属元素A的电负性。 HF HCI HBr HI 键能(kJ/mol)565427362295 氢卤酸的强度HF<HCI<HBr<HⅡ 氧族元素的氢化物H,S、H,Se及H,Te在水中均为弱酸能,不难判断 它们的酸强度是: H,S<H,Se<H,Te 在氮族元素的氢化物NH、PH3、AsH,接受质子的能力极强, PH,次之,其它的极弱碱性依次减弱
818-2-3 水溶液的酸碱性和无氧酸的强度 影响氢化物在水中的酸碱性,主要因素各两个: HA的键能和非全 属元素A的电负性。 HF HCl HBr HI 键能(kJ/mol) 565 427 362 295 氢卤酸的强度 HF<HCI<HBr<HI 氧族元素的氢化物H2 S、H2 Se及H2Te在水中均为弱酸能,不难判断 它们的酸强度是: H2 S<H2 Se<H2Te 在氮族元素的氢化物NH3、PH3、AsH3接受质子的能力极强, PH3次之,其它的极弱碱性依次减弱

18-3 含氧酸 183.1各族元素最高氧化态的氢氧化物 的酸碱性 ROH在水中有两种离解方式: ROH→R+OH碱式离解 ROH→RO+H酸式离解 ROH按碱式还是按酸式离解,与阳离子的极 化作用有关,阳离子的电荷越高、半径越小 则这ROH离子的极化作用越大
18-3 含氧酸 ⚫ 18-3-1 各族元素最高氧化态的氢氧化物 的酸碱性 ⚫ ROH在水中有两种离解方式: ⚫ ROH→R++OH- 碱式离解 ⚫ ROH→RO-+H+ 酸式离解 ⚫ ROH按碱式还是按酸式离解,与阳离子的极 化作用有关,阳离子的电荷越高、半径越小, 则这ROH离子的极化作用越大

卡特雷奇曾经把这两个因素结合在一起 老虑、提出“离子势”的概念,用离子 势表示阳离子的极化能力。 离于势即阳离子电荷与阳离子半径之 比,常用符号Φ表示。 总而言之,Rn的Φ值大。ROH是酸; Φ值小,ROH是碱。非金属元素Φ值一 般都较大,所以它们的氢氧化物为含氧 酸
卡特雷奇曾经把这两个因素结合在一起 老虑、提出“离子势”的概念,用离子 势表示阳离子的极化能力。 离于势即阳离子电荷与阳离子半径之 比,常用符号Ф表示 。 总而言之,R+n的Ф值大。ROH是酸; Ф值小,ROH是碱。非金属元素Ф值一 般都较大,所以它们的氢氧化物为含氧 酸
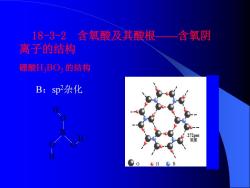
18-3-2 含氧酸及其酸根一含氧阴 离子的结构 硼酸HBO的结构 B:sp杂化 m
18-3-2 含氧酸及其酸根——含氧阴 离子的结构 硼酸H3BO3 的结构 O H B O O H H B:sp2杂化
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十七章 碳、硅、硼.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十六章 氮磷坤.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十五章 氧族元素.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十四章 卤素.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十三章 氢和稀有气体.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十二章 配位平衡.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十章 沉淀平衡.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第九章 酸碱平衡.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第八章 稀溶液的依数性.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第七章 化学动力学基础.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第六章 化学平衡常数.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第五章 化学热力学基础 Basis of Chemical Thermodynamics.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第四章 配合物.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第三章 晶体结构.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二章 分子结构.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第一章 原子结构和元素周期.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十七 开放实验——氧化铁纳米材料的制备.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十六 开放实验——土壤中硫酸根离子的测定(重量法).doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十五 开放实验——工业废水中化学需氧量(COD)的测定(高锰酸钾法).doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十四 铁铋混合液中铁铋含量的连续测定.doc
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十九章 金属通论.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十章 S区金属.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十二章 s区金属.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十三章 d区金属(一)第四周期d区金属.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十五章 f区金属、镧系与锕系金属.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第一章 绪论 Introduction.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第三章 环烷烃 cycloalkanes.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第四章 立体化学 Stereochemistry.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第六章 烯烃 alkenes.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第七章 炔烃和共轭二烯烃.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第八章 芳香化合物.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第九章 核磁共振谱、红外光谱和质谱.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十章 醇、酚.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十一章 醚.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十二章 醛和酮.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十三章 不饱和醛酮,取代醛酮,紫外光谱.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十四章 羧酸.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十五章 羧酸衍生物.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十六章 不饱和羧酸和取代羧酸.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十八章 其它含氮化合物.ppt
