河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二章 分子结构

第二章 分子结构 ·本章内容: 1.几种共价键理论:价键理论(杂化轨道理 论)、价层电子对互斥理论、分子轨道理论 重点和难点 2.路易斯结构式、σ键、π键、大π键、等电 子体 3.分子间作用力
第二章 分子结构 • 本章内容: 1.几种共价键理论:价键理论(杂化轨道理 论)、价层电子对互斥理论、分子轨道理论 ——重点和难点 2.路易斯结构式、键、键、大键、等电 子体 3.分子间作用力

共价键理论: 1、经典共价键理论 1916年,美国化学家路易斯提出 要点:原子通过共用电子对形成的化学键一共价 键。一”单键“=”双键“=”叁键 2、价键理论 1927年,德国化学家Heitler和London将量子力学理 论应用到分子结构研究中,建立了现代价键理论 (Valence Bond Theory),简称VB法,又叫电子配对法。 3、分子轨道理论 1932年,美国化学家,马利肯和洪特提出分子轨道理 论(Molecular Orbital Theory),简称MO法
共价键理论: 1、经典共价键理论 1916年,美国化学家路易斯提出 要点: 原子通过共用电子对形成的化学键——共价 键。 —”单键 “=”双键 “ ”叁键 2、价键理论 1927年, 德国化学家Heitler 和London 将量子力学理 论应用到分子结构研究中,建立了现代价键理论 (Valence Bond Theory),简称VB法,又叫电子配对法。 3、分子轨道理论 1932年,美国化学家,马利肯和洪特提出分子轨道理 论(Molecular Orbital Theory),简称MO法

2-1路易斯结构式 ·路易斯结构式:以短棍表示共价键,同时用 小黑点表示非键合的“孤对电子”的结构式叫 做路易斯结构式(Lewis structure),也叫 电子结构式
2-1 路易斯结构式 • 路易斯结构式:以短棍表示共价键,同时用 小黑点表示非键合的“孤对电子”的结构式叫 做路易斯结构式(Lewis structure),也叫 电子结构式

2-2单键、双键和叁键σ键和π键 价键理论(一) ·价键理论的要点: 1.共价键的本质: 原子相互接近时,由于原子轨道的重叠, 原子间通过共用自旋方向相反的电子对使 体系能量降低,由此形成共价键
2-2 单键、双键 和叁键——键和键 ——价键理论(一) • 价键理论的要点: 1. 共价键的本质: 原子相互接近时,由于原子轨道的重叠, 原子间通过共用自旋方向相反的电子对使 体系能量降低,由此形成共价键

2.共价键的特点 (1)共价键的形成是核对共用电子对的吸引力 (2)电子对在两核周围的空间运动在两核间空 间出现的几率最大 (3)饱和性 (4)方向性 3.共价键的键型(两种重叠方式)
2. 共价键的特点 (1) 共价键的形成是核对共用电子对的吸引力 (2) 电子对在两核周围的空间运动在两核间空 间出现的几率最大. (3) 饱和性 (4) 方向性 3. 共价键的键型(两种重叠方式)
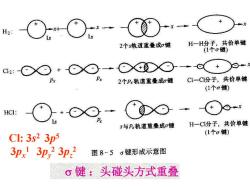
H2: 2个s轨道重叠成g健 H一H分子,共价单键 (1个o链) X⊙·⊙XX⊙ 卫3 2个Px轨道重叠成知健 CI一C分子,共价单键 (1个o健) ⊙x HCI: s与P轨道重叠成c键 H一CI分子,共价单键 (1个a键) CI:3s2 3p5 3px13p,23p2 图8-56键形成示意图 σ键:头碰头方式重叠
键 :头碰头方式重叠 Cl: 3s 2 3p 5 3px 1 3py 2 3pz 2
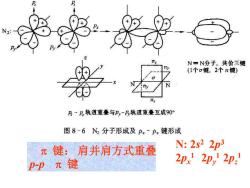
N=N分子,共价三键 (1个σ键,2个π健) 及一2轨道重叠与,-乃轨道重叠互成90° 图8-6N2分子形成及p.-p.键形成 元键:肩并肩方式重叠 N:2s22p3 p-p元键 2px 2py 2pa
键: 肩并肩方式重叠 p-p 键 N: 2s 2 2p 3 2px 1 2py 1 2pz 1
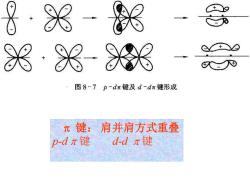
¥·米·锅 88·米-8米 图87p~dπ键及d-dπ键形成 π键:肩并肩方式重叠 p-dπ键 d-dπ键
键: 肩并肩方式重叠 p-d 键 d-d 键

δ键:两个原子的dy-dd,dz dyz' 2y2-d2y2,轨道面对面的重叠而成。 图8-88键的形成
键: 两个原子的 dxy - dxy, dxz- dxz, dyz - dyz , dx2-y2 - dx2-y2 , 轨道面对面的重叠而成

2-3价层电子对互斥模型(VSEPR) 1.要点: (I)确定孤电子对的个数:AXEm(A:中心原子,X: 配位原子,:配位原子的个数,E:中心原子上的 孤对电子对,m:孤电子对数) 则m值为:m=(A的族价-X的化合价X的个数+/-离 子电荷相应的电子数)/2 如:S02:m=(6-2*2)/2=1即有1对孤对电子 N02+:m=(5-2*2-1)/2=0即无孤对电子 S042:m=(6-2*4+2)/2=0即无孤对电子 P043-:m=(5-2*4+3)/2=0 即无孤对电子
2-3 价层电子对互斥模型(VSEPR) 1. 要点: ⑴.确定孤电子对的个数:AXnEm(A:中心原子,X: 配位原子,n:配位原子的个数,E:中心原子上的 孤对电子对,m:孤电子对数) 则m值为:m=(A的族价-X的化合价•X的个数+/-离 子电荷相应的电子数)/2 如:SO2:m=(6-2*2)/2=1 即有1对孤对电子 NO2 +:m=(5-2*2-1)/2=0 即无孤对电子 SO4 2-:m=(6-2*4+2)/2=0 即无孤对电子 PO4 3-:m=(5-2*4+3)/2=0 即无孤对电子
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第一章 原子结构和元素周期.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十七 开放实验——氧化铁纳米材料的制备.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十六 开放实验——土壤中硫酸根离子的测定(重量法).doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十五 开放实验——工业废水中化学需氧量(COD)的测定(高锰酸钾法).doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十四 铁铋混合液中铁铋含量的连续测定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十三 矿泉水的硬度测定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十二 EDTA标准溶液的配制和标定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十 酸碱标准溶液浓度的标定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验九 酸碱标准溶液的配制和比较滴定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验八 电解质溶液(微型实验).doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验七 缓冲溶液的配制与性能.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验六 粗食盐提纯.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验五 气体的发生、净化、干燥与吸收.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验四 滴定分析仪器的使用.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验三 酒精喷灯的使用和玻璃操作.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验二 分析天平的使用.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验室规则.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)化学实验的安全防护.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)化学实验操作的学习方法.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)无机及分析化学实验的目的和学习要求.doc
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第三章 晶体结构.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第四章 配合物.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第五章 化学热力学基础 Basis of Chemical Thermodynamics.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第六章 化学平衡常数.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第七章 化学动力学基础.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第八章 稀溶液的依数性.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第九章 酸碱平衡.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十章 沉淀平衡.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十二章 配位平衡.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十三章 氢和稀有气体.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十四章 卤素.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十五章 氧族元素.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十六章 氮磷坤.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十七章 碳、硅、硼.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十八章 非金属元素小结.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十九章 金属通论.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十章 S区金属.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十二章 s区金属.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十三章 d区金属(一)第四周期d区金属.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十五章 f区金属、镧系与锕系金属.ppt
