河南师范大学:《无机化学》课程教学课件(PPT讲稿)第九章 酸碱平衡

第九章酸碱平衡 1.强电解质的电离 2.弱电解质的电离平衡 3.盐类的水解 4.酸碱理论的发展
第九章 酸碱平衡 1.强电解质的电离 2.弱电解质的电离平衡 3.盐类的水解 4.酸碱理论的发展

§91.强电解质的电离
§9-1. 强电解质的电离

德拜-休克尔理论 1离子 德拜-休克尔理论指出,在强电解质溶液 中不存在分子,电离是完全的。由于离子间的 相互作用,正离子的周围围绕着负离子;负离 子的周围围绕着正离子。我们称这种现象为存 在离子氛。由于离子氛的存在,离子的活动受 到限制,正负离子间相互制约。因此1摩尔的 离子不能发挥1摩尔粒子的作用。显然溶液的 浓度越大,离子氛的作用就越大,离子的真实 浓度就越得不到正常发挥。从表中看,浓度越 大,倍数偏离2越远
德拜 - 休克尔 理论 1 .离子氛 德拜 - 休克尔理论指出,在强电解质溶液 中不存在分子, 电离是完全的。由于离子间的 相互作用,正离子的周围围绕着负离子;负离 子的周围围绕着正离子。 我们称这种现象为存 在离子氛。由于离子氛的存在,离子的活动受 到限制,正负离子间相互制约。因此 1 摩尔的 离子不能发挥 1 摩尔粒子的作用。显然溶液的 浓度越大,离子氛的作用就越大,离子的真实 浓度就越得不到正常发挥。从表中看,浓度越 大,倍数偏离 2 越远

2活度系数 若强电解质的离子浓度为c,由于离子氛 的作用,其发挥的有效浓度为a,则有真分数f 存在,使a=fc式中,c浓度,a有效浓度即 活度,f活度系数。用f修正后,得到活度a,它 能更真实地体现溶液的行为。 影响活度系数f大小的因素有: 1)溶液的浓度:浓度大,活度a偏离浓度c越 远,f越小;浓度小,a和c越接近,f越接近 于1
2 活度系数 若强电解质的离子浓度为 c , 由于离子氛 的作用,其发挥的有效浓度为 a , 则有真分数 f 存在,使 a = f ·c 式中,c 浓度,a 有效浓度即 活度,f 活度系数。用 f 修正后, 得到活度 a , 它 能更真实地体现溶液的行为。 ⚫ 影响活度系数 f 大小的因素有: 1) 溶液的浓度:浓度大,活度 a 偏离浓度 c 越 远,f 越小; 浓度小,a 和 c 越接近,f 越接近 于 1

。2)离子的电荷:电荷高,离子氛作用大, a和c偏离大,f小。电荷低,离子氛作 用小,a和c接近,f接近于1。 讨论问题,有时要用到a和f,但是 在本章的计算中,如 不特殊指出,则认为a=c,f=1。 弱电解质的溶液中,也有离子氛存 在,但是更重要的是电离平衡的存在
⚫ 2) 离子的电荷:电荷高,离子氛作用大, a 和 c 偏离大, f 小。 电荷低,离子氛作 用小,a 和 c 接近,f 接近于 1。 讨论问题,有时要用到 a 和 f,但是 在本章的计算中,如 不特殊指出,则认为 a = c , f = 1。 弱电解质的溶液中,也有离子氛存 在,但是更重要的是电离平衡的存在

§9-2.弱电解质的电离平衡
§9-2.弱电解质的电离平衡

一水的电离平衡 1.水的离子积常数 H,0(I)=(aq)+0H(aq) K=[H][O] 式中的K称为水的离子积常数,经常用w表 示。Kw是标准平衡常数,式中的浓度都是相 对浓度。由于本章中使用标准浓度极其频繁, 故省略除以的写法。要注意它的实际意义。 H,O=H++OH △H>0吸热反应
一.水的电离平衡 1. 水的离子积常数 式中的 K 称为水的离子积常数,经常用 Kw 表 示。Kw 是标准平衡常数,式中的浓度都是相 对浓度。由于本章中使用标准浓度极其频繁, 故省略除以的写法。要注意它的实际意义。 H2O = H+ + OH- △ H > 0 吸热反应
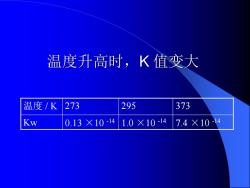
温度升高时,K值变大 温度/K 273 295 373 Kw 0.13×10-14 1.0×10-14 7.4×10-14
温度升高时,K 值变大 温度 / K 273 295 373 Kw 0.13 ×10 -14 1.0 ×10 -14 7.4 ×10 -14

二弱酸和弱减的电离平衡 。1电离平衡常数 将醋酸的分子式简写成HAc,用Ac 代表醋酸根,则醋酸的电离平衡可以表示 成:HAc=H+Ac醋酸的电离平衡常数 表示为 [H+][Ac-] K2=1.8×10-5 [HA.]
二 弱酸和弱减的电离平衡 ⚫ 1 电离平衡常数 将醋酸的分子式简写成 HAc , 用 Ac- 代表醋酸根 , 则醋酸的电离平衡可以表示 成:HAc = H+ + Ac-,醋酸的电离平衡常数 表示为

。平衡常数表示处于平衡状态的几种物质的浓度 关系,确切地说是活度的关系。但是在我们的 计算中,近似地认为活度系数f=1,即用浓度 代替活度。KaKb,的大小可以表示弱酸和弱 碱的离解程度,K的值越大,则弱酸和弱碱的 电离程度越大。 2关于电离平衡的计算 例1.已知HF的Ka=6.6×10-14,求0.01的H 溶液的[H]
⚫ 平衡常数表示处于平衡状态的几种物质的浓度 关系,确切地说是活度的关系。但是在我们的 计算中,近似地认为活度系数 f = 1,即用浓度 代替活度。 Ka Kb, 的大小可以表示弱酸和弱 碱的离解程度,K 的值越大,则弱酸和弱碱的 电离程度越大。 2 关于电离平衡的计算 例 1. 已知 HF 的 Ka = 6.6 ×10 -14 ,求 0.01 的 HF 溶液的 [ H+ ]
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第八章 稀溶液的依数性.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第七章 化学动力学基础.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第六章 化学平衡常数.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第五章 化学热力学基础 Basis of Chemical Thermodynamics.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第四章 配合物.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第三章 晶体结构.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二章 分子结构.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第一章 原子结构和元素周期.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十七 开放实验——氧化铁纳米材料的制备.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十六 开放实验——土壤中硫酸根离子的测定(重量法).doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十五 开放实验——工业废水中化学需氧量(COD)的测定(高锰酸钾法).doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十四 铁铋混合液中铁铋含量的连续测定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十三 矿泉水的硬度测定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十二 EDTA标准溶液的配制和标定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验十 酸碱标准溶液浓度的标定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验九 酸碱标准溶液的配制和比较滴定.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验八 电解质溶液(微型实验).doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验七 缓冲溶液的配制与性能.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验六 粗食盐提纯.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验五 气体的发生、净化、干燥与吸收.doc
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十章 沉淀平衡.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十二章 配位平衡.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十三章 氢和稀有气体.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十四章 卤素.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十五章 氧族元素.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十六章 氮磷坤.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十七章 碳、硅、硼.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十八章 非金属元素小结.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十九章 金属通论.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十章 S区金属.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十二章 s区金属.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十三章 d区金属(一)第四周期d区金属.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十五章 f区金属、镧系与锕系金属.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第一章 绪论 Introduction.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第三章 环烷烃 cycloalkanes.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第四章 立体化学 Stereochemistry.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第六章 烯烃 alkenes.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第七章 炔烃和共轭二烯烃.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第八章 芳香化合物.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第九章 核磁共振谱、红外光谱和质谱.ppt
