《实验化学》课程教学课件(PPT讲稿)电解质溶液

电解质溶液
电 解 质 溶 液

目的要求1。进一步理解电解质电离的特点,了解影响电离平衡移动的因素·2掌握缓冲溶液的配制和性质·3.了解盐类水解和影响盐类水解的因素
一、目的要求 • 1.进一步理解电解质电离的特点,了解影 响电离平衡移动的因素。 • 2.掌握缓冲溶液的配制和性质。 • 3. 了解盐类水解和影响盐类水解的因素

基本原理二、1.强电解质和弱电解质强电解质在水溶液中是完全电离的,不存在电离平衡,弱电解质是部分电离,存在电离平衡。2.同离子效应和缓冲溶液在弱电解质溶液中,加入含有共同离子的强电解质,可使弱电解质的电离度降低,这种效应称为同离子效应缓冲溶液是指弱酸或弱碱及其盐所组成的溶液能够抵抗少量外加酸、碱或稀释,pH值基本保持不变。3.弱电解质的电离平衡与盐的水解有些离子能够与水反应,给出质子或接受质子形成难电离的弱电解质,使溶液显出不同的酸碱性,此即为盐的水解
二、基本原理 1.强电解质和弱电解质。 强电解质在水溶液中是完全电离的,不存在电离 平衡,弱电解质是部分电离,存在电离平衡。 2.同离子效应和缓冲溶液 在弱电解质溶液中,加入含有共同离子的强电解 质,可使弱电解质的电离度降低,这种效应称为同 离子效应。 缓冲溶液是指弱酸或弱碱及其盐所组成的溶液, 能够抵抗少量外加酸、碱或稀释,pH值基本保持 不变。 3.弱电解质的电离平衡与盐的水解 有些离子能够与水反应,给出质子或接受质子, 形成难电离的弱电解质,使溶液显出不同的酸碱性, 此即为盐的水解

4.难溶电解质的沉淀溶解平衡与溶度积常数难溶电解质的饱和水溶液中,存在沉淀和溶解的多相平衡,例如:AgC1 (S)Ag(aq)+Cl(aq)溶度积常数Ksp=C(Agt)·C(CI)。5.沉淀的次序与转化当溶液中含有几种可被同一种沉淀剂沉淀的离子时,加入沉淀剂,由于被沉淀离子的浓度和溶度积不同,所以形成沉淀的先后顺序不同。同理,一种难溶物在一定条件下,也可以转化成另一种难溶物
4.难溶电解质的沉淀溶解平衡与溶度积常数 难溶电解质的饱和水溶液中,存在沉淀和溶解 的多相平衡,例如: AgCl(S)Ag+ (aq)+Cl- (aq) 溶度积常数 Ksp=C(Ag+ )·C(Cl- )。 5.沉淀的次序与转化 当溶液中含有几种可被同一种沉淀剂沉淀的离 子时,加入沉淀剂,由于被沉淀离子的浓度和溶度 积不同,所以形成沉淀的先后顺序不同。同理,一 种难溶物在一定条件下,也可以转化成另一种难溶 物

(略)仪器和药品三、←四、实验内容强电解质和弱电解质(1)比较盐酸和醋酸的酸性a.稀HCI和HAc溶液各加甲基橙指示剂,观察溶液颜色;b.稀HCI和HAc溶液各加一颗锌粒,比较反应快慢(2)用pH试纸测定下列各溶液的pH值,并和计算值比较结果填入下表溶液HC1HAcNaOHNa,S NHCINH,H,ONHAc0.1mol/LpH测定值pH计算值
1、强电解质和弱电解质 (1)比较盐酸和醋酸的酸性 a.稀HCl和HAc溶液各加甲基橙指示剂,观察溶液颜色; b.稀HCl和HAc溶液各加一颗锌粒,比较反应快慢。 (2)用pH试纸测定下列各溶液的pH值,并和计算值比较, 结果填入下表 三、仪器和药品(略) 四、实验内容 溶液 0.1mol/L HCl HAc NaOH NH3H2O Na2S NH4Cl NH4Ac pH测定值 pH计算值
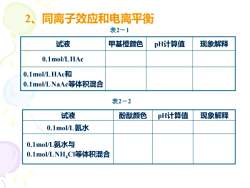
同离子效应和电离平衡21表2—1试液甲基橙颜色pH计算值现象解释0.1mol/LHAc0.1mol/LHAc和0.1mol/LNaAc等体积混合表2—2试液酚酸颜色pH计算值现象解释0.1mol/L氨水0.1mol/L氨水与0.1mol/LNHCI等体积混合
2、同离子效应和电离平衡 试液 甲基橙颜色 pH计算值 现象解释 0.1mol/L HAc 0.1mol/L HAc和 0.1mol/L NaAc等体积混合 试液 酚酞颜色 pH计算值 现象解释 0.1mol/L 氨水 0.1mol/L氨水与 0.1mol/L NH4Cl等体积混合 表2-1 表2-2

3.缓冲溶液的配制和性质HAc-NaAc与氨水-NHCI缓冲溶液4.沉淀的生成和溶解(1)BaCl+(NH4)2C2O4沉淀再加HCl;(2)AgNO3+NaCl,+NH,H,O;(3)AgNO3+Na2S,沉淀再加HNO3观察现象,写出化学方程式并对现象解释;5.分步沉淀和沉淀的转化(1)NaS+K,CrO4,清液加Pb(NO3)2,观察沉淀根据溶度积常数加以说明;(2)Pb(NO3)2+NaCl,离心沉淀加KL离心沉淀再加Na2S,观察沉淀用上述生成物溶解度数据解释各现象,小结沉淀条件
3.缓冲溶液的配制和性质 HAc-NaAc与氨水- NH4Cl缓冲溶液 4.沉淀的生成和溶解 (1) BaCl2+(NH4 )2C2O4 ,沉淀再加HCl; (2) AgNO3+NaCl,+ NH3H2O; (3) AgNO3+ Na2S,沉淀再加HNO3; 观察现象,写出化学方程式并对现象解释; 5.分步沉淀和沉淀的转化 (1) Na2S+K2CrO4,清液加Pb(NO3 )2,观察沉淀, 根据溶度积常数加以说明; (2) Pb(NO3 )2+ NaCl,离心沉淀加KI,离心沉淀再加 Na2S,观察沉淀, 用上述生成物溶解度数据解释各现象,小结沉 淀条件

五、思考题1、欲配制pH=7.03的缓冲溶液20mL,应选用本实验中的哪两种试剂?怎样配制?通过计算说明,2、配制FeCl3、SnCl、BiCl3、SbCl,等物质的溶液时应注意什么问题?3、为什么NaHCO溶液呈碱减性,而NaHSO溶液呈酸性?4怎样验证Al(SO4)和NaCO3作用生成的沉淀是AI(OH)而不是AI2(CO3)3?5、在沉淀转化实验中能否用比较PbCl、Pbl2PbS的Ksp值来说明有关沉淀转化的原因?
五、思考题 1、欲配制pH=7.03的缓冲溶液20mL,应选用本实验 中的哪两种试剂?怎样配制?通过计算说明。 2、配制FeCl3、 SnCl2 、 BiCl3、 SbCl3 等物质的溶 液时应注意什么问题? 3、为什么NaHCO3溶液呈碱性,而NaHSO4溶液呈 酸性? 4、怎样验证Al2 (SO4 )3和Na2CO3作用生成的沉淀是 Al(OH)3而不是Al 2 (CO3 )3? 5、在沉淀转化实验中能否用比较PbCl2、 PbI2、 PbS的KSP值来说明有关沉淀转化的原因?

六、注意事项本实验为性质实验,的是通过实验巩固学生对理论性质的掌握。需注意提醒学生明确实验的目的,注意观察比较实验现象,学会分析实验现象背后的理论原因
六、注意事项 本实验为性质实验,目的是通过实 验巩固学生对理论性质的掌握。需注 意提醒学生明确实验的目的,注意观 察比较实验现象,学会分析实验现象 背后的理论原因
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《实验化学》课程教学课件(PPT讲稿)铵盐中氮含量的测定(甲醛法).ppt
- 《实验化学》课程教学课件(PPT讲稿)Na2CO3和NaHCO3混合碱含量的测定(双指示剂法).ppt
- 《实验化学》课程教学课件(PPT讲稿)化学反应速率和化学平衡.ppt
- 《实验化学》课程教学课件(PPT讲稿)配合物的生成和性质.ppt
- 《实验化学》课程教学课件(PPT讲稿)玻璃加工和塞子钻孔.ppt
- 《实验化学》课程教学课件(PPT讲稿)水的硬度及钙镁含量的测定.ppt
- 《实验化学》课程教学课件(PPT讲稿)酸碱标准溶液的配制和比较滴定.ppt
- 《实验化学》课程教学课件(PPT讲稿)氧化还原反应.ppt
- 《实验化学》课程教学课件(PPT讲稿)乙酰乙酸乙酯的制备 Preparation of Ethyl Acetoacetate.ppt
- 《实验化学》课程教学课件(教案讲义六).doc
- 《实验化学》课程教学课件(教案讲义五).doc
- 《实验化学》课程教学课件(教案讲义四).doc
- 《实验化学》课程教学课件(教案讲义三).doc
- 《实验化学》课程教学课件(教案讲义二).doc
- 《实验化学》课程教学课件(教案讲义一).doc
- 《实验化学》课程教学大纲 Experiment chemistry Ⅱ.doc
- 《实验化学》课程教学大纲 Experiment chemistry Ⅰ.doc
- 《实验化学》课程教学大纲 Experiment chemistry A.doc
- 《无机及分析化学》课程教学资源(PPT课件)第九章 配位化合物与配位滴定 Coordination Compound.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第八章 沉淀平衡.ppt
- 《实验化学》课程教学课件(PPT讲稿)醋酸电离度和电离常数的测定.ppt
- 《实验化学》课程教学课件(PPT讲稿)粗食盐的提纯.ppt
- 《医用基础化学》课程教学大纲 Medic Basis Chemistry.doc
- 《医学有机化学》课程教学大纲 Medicinal Organic Chemistry.doc
- 《医用基础化学实验》课程教学大纲.doc
- 《医学有机化学实验》课程教学大纲 Organic chemistry.doc
- 《医学有机化学》课程教学资源(授课教案)医用基础化学教案2011-2012学年第一学期.doc
- 《医学有机化学》课程教学资源(授课教案)医用基础化学实验2011-2012学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)医学有机化学教案2010-2011学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)有机化学实验教案2010-2011学年第二学期.doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-2-实验指导-有机化学实验(共十九个实验).doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-1-实验指导-无机实验.doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-1-实验指导-基础部分.doc
- 《医学有机化学》课程学习指导(医用基础化学)第十三章 可见分光光度法和紫外分光光度法(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十四章 现代仪器分析简介(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十二章 滴定分析(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)综合测试题(无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十章 共价键与分子间力(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第八章 氧化还原反应与电极电位(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十一章 配位化合物(含测试,无答案).doc
