《实验化学》课程教学课件(PPT讲稿)化学反应速率和化学平衡

化学反应速率和化学平衡
化 学 反 应 速 率 和 化 学 平 衡

实验目的1.掌握浓度、温度、催化剂对化学反应速率的影响。2.掌握浓度、温度对化学平衡的影响。3.学习试剂取用等基本操作
一、实验目的 1.掌握浓度、温度、催化剂对化学反应速率 的影响。 2.掌握浓度、温度对化学平衡的影响。 3.学习试剂取用等基本操作

基本原理二化学反应速率与各反应物以反应计量系数为指数的物质的量浓度的乘积成正比,这一规律叫质量作用定律。(其数学表达式为)v=kca(A)cb(B)),它仅适用于基元反应实际上很多反应是由几个连续进行的反应组成的,即复杂反应
二、基本原理 化学反应速率与各反应物以反应计量系 数为指数的物质的量浓度的乘积成正比,这一 规律叫质量作用定律。(其数学表达式为: v=kca(A)cb(B)),它仅适用于基元反应。 实际上很多反应是由几个连续进行的反应组成 的,即复杂反应

例如,HIO和H,SO在水中的反应:HIO3+3H2SO3=HI+3H2SO4其反应历程为:(1)HIO3+H2SO3=HIO2+H2SO4(2)HIO2+2H2SO3=HI+2H2SO4(3)5HI+HI03=3I2+3H20(4)I2+H2SO3+H2O=2HI+H2SO4通过实验发现:上述反应速率大小顺序为(4)>(3)>(2)>(1)。因此,只要溶液中有H2SO3存在,I就很和H2SO,反应。只有H2SO3全部作用完以后,反应(3)所生成的I2才可能存在,并与溶液中预先加入的淀粉作用而呈蓝色。于是,可用溶液中蓝色的出现作为H,SO3反应完的标志,出现蓝色的时间越长,表示反应速率越慢;反之,则反应越快
例如,HIO3和 H2 SO3在水中的反应: HIO3+3H2 SO3=HI+3H2 SO4 其反应历程为: HIO3+H2 SO3=HIO2+H2 SO4 (1) HIO2+2H2 SO3=HI+2H2 SO4 (2) 5HI+HIO3=3I2+3H2O (3) I2+H2 SO3 +H2O=2HI+H2 SO4 (4) 通过实验发现:上述反应速率大小顺序为(4)>(3)>(2) >(1)。因此,只要溶液中有 H2 SO3存在,I2就很和 H2 SO3反应。 只有 H2 SO3全部作用完以后,反应(3)所生成的 I2 才可能存在, 并与溶液中预先加入的淀粉作用而呈蓝色。于是,可用溶液中蓝 色的出现作为 H2 SO3 反应完的标志,出现蓝色的时间越长,表示 反应速率越慢;反之,则反应越快

温度升高,反应速率增大,这主要是由于活化分子的百分数增大,从而使活化分子总数大大增多,有效碰撞次数增加的缘故。催化剂之所以能加快反应速率,是因为它能改变反应途径,降低反应的活化能根据勒.沙特列原理,当可逆反应达到平衡时,如果改变某一条件(如浓度,温度等),平衡就向减弱这个改变的方向移动
温度升高,反应速率增大,这主要是由于活化分子的 百分数增大,从而使活化分子总数大大增多,有效碰撞 次数增加的缘故。催化剂之所以能加快反应速率,是因 为它能改变反应途径,降低反应的活化能。 根据勒.沙特列原理,当可逆反应达到平衡时,如果 改变某一条件(如浓度,温度等),平衡就向减弱这个改 变的方向移动

三、仪器和药品仪器:量筒(5mL)、烧杯(20mL)、试管、温度计、秒表、玻璃棒、N2O4-NO,平衡球。药品:HIO3(0.0040mol.L")H2SO3 (0.0080mol.L-l)MnSO4 (0.1mol.L-')H2SO4 (0.1mol.L-)H02 (3%)(NH4)2C,O4 (0.1mol.L-1)KMnO4 (0.1mol.L-I)FeCl3(0.1mol.L-)NHμSCN(0.1mol.L-1)MnO2(S)NHCI(S)蒸馏水冰淀粉(0.5%)
三、仪器和药品 仪器:量筒(5mL)、烧杯(20mL)、试管、温度计、秒表、 玻璃棒、N2O4 - NO2平衡球。 药品: HIO3(0.0040mol.L-1 ) H2SO3(0.0080mol.L-1 ) H2O2(3%) H2SO4(0.1mol.L-1 ) MnSO4(0.1mol.L-1 ) (NH4 )2C2O4(0.1mol.L-1 ) KMnO4(0.1mol.L-1 ) FeCl3 (0.1mol.L-1 ) NH4SCN(0.1mol.L-1 ) MnO2 (S) NH4Cl(S) 蒸馏水 冰 淀粉(0.5%)
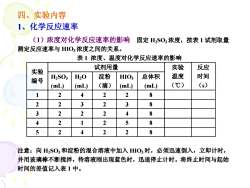
四、实验内容1、化学反应速率(1)浓度对化学反应速率的影响固定H,SO.浓度,按表1试剂取量测定反应速率与HIO,浓度之间的关系,表1浓度、温度对化学反应速率的影响反应实验试剂用量实验温度时间淀粉HIO3总体积H,SO3H20编号(℃)(s)(滴)(mL)(mL)(mL)(mL)122248223238322248421258524228注意:向H2SO和淀粉的混合溶液中加入HIO,时,必须迅速倒入,立即计时,并用玻璃棒不断搅拌,待溶液刚出现蓝色时,迅速停止计时。将终止时间与起始时间的差值记入表1中
四、实验内容 1、化学反应速率 (1)浓度对化学反应速率的影响 固定 H2SO3 浓度,按表 1 试剂取量 测定反应速率与 HIO3浓度之间的关系。 表 1 浓度、温度对化学反应速率的影响 注意:向 H2SO3和淀粉的混合溶液中加入 HIO3时,必须迅速倒入,立即计时, 并用玻璃棒不断搅拌,待溶液刚出现蓝色时,迅速停止计时。将终止时间与起始 时间的差值记入表 1 中。 试剂用量 实验 编号 H2SO3 (mL) H2O (mL) 淀粉 (滴) HIO3 (mL) 总体积 (mL) 实验 温度 (℃) 反应 时间 (s) 1 2 4 2 2 8 2 2 3 2 3 8 3 2 2 2 4 8 4 2 1 2 5 8 5 2 4 2 2 8

(2)温度对化学反应速率的影响反应物浓度固定,测定反应速率与温度的关系。按表1编号为5的一栏中试剂取量,先将HSO.和淀粉的混合溶液与HIO.溶液分别同时放在冰浴中,待降至0℃,再按上述方法进行测定。将终止时间与起始时间的差值记入表1编号为5的一栏中
(2)温度对化学反应速率的影响 反应物浓度固定,测定反应速率与温度的关系。 按表 1 编号为 5 的一栏中试剂取量,先将 H2SO3和淀 粉的混合溶液与 HIO3溶液分别同时放在冰浴中,待降 至 0℃,再按上述方法进行测定。将终止时间与起始 时间的差值记入表 1 编号为 5 的一栏中
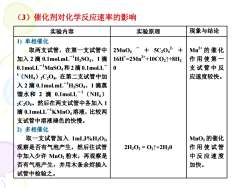
(3)催化剂对化学反应速率的影响现象与结论实验内容实验原理1)单相催化2Mn04-+ 5C202- +Mn2+的催化取两支试管,在第一支试管中16H*=2Mn2++10C02↑+8H2作用使第一加入2滴0.1molmL-HSO4、1滴0支试管中反0.1mol.L-IMnSO4和2滴0.1mol.L1(NH)2C,04,在第二支试管中加应速度较快。入2滴0.1mol.mL-H2SO4、1滴蒸馏水和 2滴0.1mol.L-1(NH)2C04。然后在两支试管中各加入1滴0.1mol.L-"KMnO4溶液,比较两支试管中溶液褪色的快慢。2)多相催化MnO2的催化取一支试管加入1mL3%H,02,作用使试管观察是否有气泡产生,然后往试管2H,0,=02个+2H20中反应速度中加入少许MnO2粉末,再观察是加快。否有气泡产生,并用木条余煜插入试管中检验之
(3)催化剂对化学反应速率的影响 实验内容 实验原理 现象与结论 1) 单相催化 取两支试管,在第一支试管中 加入 2 滴 0.1mol.mL-1 H2SO4、1 滴 0.1mol.L-1 MnSO4和 2滴 0.1mol.L- 1 (NH4)2C2O4, 在第二支试管中加 入 2 滴 0.1mol.mL-1 H2SO4、1 滴蒸 馏水和 2 滴 0.1mol.L- 1 (NH4) 2C2O4。然后在两支试管中各加入 1 滴 0.1mol.L-1 KMnO4溶液,比较两 支试管中溶液褪色的快慢。 2) 多相催化 取一支试管加入 1mL3%H2O2, 观察是否有气泡产生,然后往试管 中加入少许 MnO2 粉末,再观察是 否有气泡产生,并用木条余烬插入 试管中检验之。 2MnO4 - + 5C2O4 2- + 16H+ =2Mn2++10CO2↑+8H2 0 2H2O2 = O2↑+2H20 Mn2+ 的催化 作 用 使 第 一 支 试 管 中 反 应速度较快。 MnO2 的催化 作 用 使 试 管 中 反 应 速 度 加快
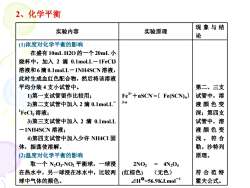
2、化学平衡现象与结实验内容实验原理论(1)浓度对化学平衡的影响在盛有10mLH20的一个20mL小烧杯中,加入2滴0.1molL一1FeCI3溶液和6滴0.1mol.L一1NH4SCN溶液,此时生成血红色配合物,然后将该溶液第二、三支平均分装4支小试管中。Fe3++nSCN'-( Fe(SCN),)试管中,溶1)第一支试管留作比较用;3-n2)第二支试管中加入2滴0.1mol.L-液颜色变"FeCl,溶液;深;第四支试管中,溶3)第三支试管中加入2滴0.1molL液颜色变一1NH4SCN溶液;浅。符合4)第四支试管中加入少许NH4CI固勒。沙特列体,振荡使溶解原理。(2)温度对化学平衡的影响取一个N2O4-NO,平衡球,一球浸2NO24N204=(无色)符合范特在热水中,另一球浸在冰水中,比较两(红棕色)4H°=56.9KJ.mol-1球中气体的颜色。霍夫公式
2、化学平衡 实验内容 实验原理 现象与结 论 (1)浓度对化学平衡的影响 在盛有 10mL H2O的一个 20mL 小 烧杯中,加入 2 滴 0.1mol.L-1FeCl3 溶液和 6滴 0.1mol.L-1NH4SCN溶液, 此时生成血红色配合物,然后将该溶液 平均分装 4 支小试管中。 1)第一支试管留作比较用; 2)第二支试管中加入 2 滴 0.1mol.L- 1 FeCl3溶液; 3)第三支试管中加入 2 滴 0.1mol.L -1NH4SCN 溶液; 4)第四支试管中加入少许 NH4Cl 固 体,振荡使溶解。 (2)温度对化学平衡的影响 取一个 N2O4 -NO2 平衡球,一球浸 在热水中,另一球浸在冰水中,比较两 球中气体的颜色。 Fe3++nSCN- =〔 Fe(SCN)n〕 3-n 2NO2 = 4N2O4 (红棕色) (无色) ⊿H ◎=56.9KJ.mol-1 第二、三支 试管中,溶 液颜色变 深;第四支 试管中,溶 液颜色变 浅。符合 勒。沙特列 原理。 符合范特 霍夫公式
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《实验化学》课程教学课件(PPT讲稿)配合物的生成和性质.ppt
- 《实验化学》课程教学课件(PPT讲稿)玻璃加工和塞子钻孔.ppt
- 《实验化学》课程教学课件(PPT讲稿)水的硬度及钙镁含量的测定.ppt
- 《实验化学》课程教学课件(PPT讲稿)酸碱标准溶液的配制和比较滴定.ppt
- 《实验化学》课程教学课件(PPT讲稿)氧化还原反应.ppt
- 《实验化学》课程教学课件(PPT讲稿)乙酰乙酸乙酯的制备 Preparation of Ethyl Acetoacetate.ppt
- 《实验化学》课程教学课件(教案讲义六).doc
- 《实验化学》课程教学课件(教案讲义五).doc
- 《实验化学》课程教学课件(教案讲义四).doc
- 《实验化学》课程教学课件(教案讲义三).doc
- 《实验化学》课程教学课件(教案讲义二).doc
- 《实验化学》课程教学课件(教案讲义一).doc
- 《实验化学》课程教学大纲 Experiment chemistry Ⅱ.doc
- 《实验化学》课程教学大纲 Experiment chemistry Ⅰ.doc
- 《实验化学》课程教学大纲 Experiment chemistry A.doc
- 《无机及分析化学》课程教学资源(PPT课件)第九章 配位化合物与配位滴定 Coordination Compound.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第八章 沉淀平衡.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第七章 酸碱平衡与酸碱滴定.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第六章 分析化学概论.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第四章 物质结构简介.ppt
- 《实验化学》课程教学课件(PPT讲稿)Na2CO3和NaHCO3混合碱含量的测定(双指示剂法).ppt
- 《实验化学》课程教学课件(PPT讲稿)铵盐中氮含量的测定(甲醛法).ppt
- 《实验化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《实验化学》课程教学课件(PPT讲稿)醋酸电离度和电离常数的测定.ppt
- 《实验化学》课程教学课件(PPT讲稿)粗食盐的提纯.ppt
- 《医用基础化学》课程教学大纲 Medic Basis Chemistry.doc
- 《医学有机化学》课程教学大纲 Medicinal Organic Chemistry.doc
- 《医用基础化学实验》课程教学大纲.doc
- 《医学有机化学实验》课程教学大纲 Organic chemistry.doc
- 《医学有机化学》课程教学资源(授课教案)医用基础化学教案2011-2012学年第一学期.doc
- 《医学有机化学》课程教学资源(授课教案)医用基础化学实验2011-2012学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)医学有机化学教案2010-2011学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)有机化学实验教案2010-2011学年第二学期.doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-2-实验指导-有机化学实验(共十九个实验).doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-1-实验指导-无机实验.doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-1-实验指导-基础部分.doc
- 《医学有机化学》课程学习指导(医用基础化学)第十三章 可见分光光度法和紫外分光光度法(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十四章 现代仪器分析简介(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十二章 滴定分析(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)综合测试题(无答案).doc
