《医学有机化学》课程学习指导(医用基础化学)第十一章 配位化合物(含测试,无答案)

第十一章配位化合物内容提要第一节配位化合物的基本概念一、配位化合物的定义配位化合物(简称配合物)是以具有接受电子对的离子或原子(统称中心原子)为中心,与一组可以给出电子对的离子或分子(统称配体),以一定的空间排列方式在中心原子周围所组成的质点(配离子或配分子)为特征的化合物。二、配合物的组成多数配合物由配离子与带有相反电荷的离子组成。中心原子提供空轨道,配体中的配位原子提供孤对电子,组成配离子。常见配位原子有N、O、C、S、F、Cl、Br、I等。只含有一个配位原子的配体称为单齿配体。含有两个或两个以上配位原子的配体称多齿配体。三、配合物的命名1.配合物遵守无机化合物的命名原则:阴离子在前、阳离子在后,以二元化合物命名。如某化某”、“某酸”、“氢氧化某”和“某酸某”。2.配离子及配位分子的命名:配体名称在前,配体数目用二、三、四等数字表示,复杂配体名称写在圆括号中,以免混淆,不同配体以中圆点“”分开,配体名称之后以“合”字联接中心原子,其后加括号以的马数字表示氧化值,3.配体命名按如下顺序确定:(1)无机配体在前,有机配体在后:(2)先列阴离子,后列中性分子:(3)同为阴离子或中性分子时按配位原子元素符号的英文字母顺序列出;(4)化学式相同、配位原子不同的配体,按配位原子元素符号的英文字母顺序排列;(5)同时存在配位原子相同、所含原子的数目也相同的配体时,按与配位原子相连的原子的元素符号英文字母顺序进行。第二节配合物的化学键理论
第十一章 配位化合物 内 容 提 要 第一节 配位化合物的基本概念 一、配位化合物的定义 配位化合物(简称配合物)是以具有接受电子对的离子或原子(统称中心原 子)为中心,与一组可以给出电子对的离子或分子(统称配体),以一定的空间 排列方式在中心原子周围所组成的质点(配离子或配分子)为特征的化合物。 二、配合物的组成 多数配合物由配离子与带有相反电荷的离子组成。中心原子提供空轨道,配 体中的配位原子提供孤对电子,组成配离子。常见配位原子有 N、O、C、S、F、 Cl、Br、I 等。只含有一个配位原子的配体称为单齿配体。含有两个或两个以上 配位原子的配体称多齿配体。 三、配合物的命名 1. 配合物遵守无机化合物的命名原则:阴离子在前、阳离子在后,以二元 化合物命名。如“某化某”、“某酸”、“氢氧化某”和“某酸某”。 2. 配离子及配位分子的命名:配体名称在前,配体数目用二、三、四等数 字表示,复杂配体名称写在圆括号中,以免混淆,不同配体以中圆点“·”分开, 配体名称之后以“合”字联接中心原子,其后加括号以的马数字表示氧化值。 3. 配体命名按如下顺序确定: (1)无机配体在前,有机配体在后; (2)先列阴离子,后列中性分子; (3)同为阴离子或中性分子时按配位原子元素符号的英文字母顺序列出; (4)化学式相同、配位原子不同的配体,按配位原子元素符号的英文字母 顺序排列; (5)同时存在配位原子相同、所含原子的数目也相同的配体时,按与配位 原子相连的原子的元素符号英文字母顺序进行。 第二节 配合物的化学键理论

一、配合物的价键理论价键理论的基本要点:1.中心原子与配体中的配位原子之间以配位键结合。2.为了增强成键能力,中心原子所提供的空轨道首先进行杂化,形成数目相等、能量相同、具有一定空间伸展方向的杂化轨道。3.配合物的空间构型,取决于中心原子所提供的杂化轨道的数目和类型。配合物属内轨还是外轨,可通过配合物的磁矩(μu)的测定来判断。μ与未成对电子数n的关系为μ=/n(n+2)μg。二、晶体场理论晶体场理论的基本要点1.中心原子与配体之间靠静电作用力相结合。2.中心原子在配体所形成的负电场作用下,5个能量相同的简并d轨道能级发生了分裂,有些d轨道能量升高,有些降低。3.中心原子的d电子重新排布在能级发生分裂的d轨道上,使系统总能量降低,配合物更稳定。(一)在八面体配位场中中心原子d轨道能级分裂中心原子d轨道能级分裂成两组:一组为高能量d能级二重简并的d,和dr-轨道;一组为低能量de能级三重简并的dy、d-和dy-轨道。(二)分裂能及其影响因素1.分裂能能级分裂后中心原子d轨道最高能级与最低能级的能量差为分裂能,用△表示。八面体场分裂能用△。表示。d能级上升0.6△o,d.能级下降0.4△。2.影响分裂能的因素有配体的性质、中心原子的氧化值和中心原子的半径。(1)配体的场强愈大,分裂能愈大。正八面体配合物的光谱实验得出的配体场强由弱到强顺序:I-<Br<CI<SCN-<F-<S2032-<0H~ONO<C2042-<H20<NCS-~EDTA<NH3<en<SO32-<NO2<<CN-<CO(2)中心原子的氧化值中心原子的氧化值愈高,分裂能愈大
一、配合物的价键理论 价键理论的基本要点: 1.中心原子与配体中的配位原子之间以配位键结合。 2.为了增强成键能力,中心原子所提供的空轨道首先进行杂化,形成数目相 等、能量相同、具有一定空间伸展方向的杂化轨道。 3.配合物的空间构型,取决于中心原子所提供的杂化轨道的数目和类型。 配合物属内轨还是外轨,可通过配合物的磁矩(μ)的测定来判断。μ 与未 成对电子数 n 的关系为 μ n n B = ( + 2) 。 二、晶体场理论 晶体场理论的基本要点 1.中心原子与配体之间靠静电作用力相结合。 2.中心原子在配体所形成的负电场作用下,5 个能量相同的简并 d 轨道能级 发生了分裂,有些 d 轨道能量升高,有些降低。 3. 中心原子的 d 电子重新排布在能级发生分裂的 d 轨道上,使系统总能量 降低,配合物更稳定。 (一)在八面体配位场中中心原子 d 轨道能级分裂 中心原子 d 轨道能级分裂成两组:一组为高能量 dγ 能级二重简并的 d 2 z 和 d 2 2 x −y 轨道;一组为低能量 dε 能级三重简并的 dxy、dxz和 dyz 轨道。 (二)分裂能及其影响因素 1.分裂能 能级分裂后中心原子 d 轨道最高能级与最低能级的能量差为分裂 能,用 Δ 表示。八面体场分裂能用 Δo 表示。dγ 能级上升 0.6Δo, d 能级下降 0.4Δo。 2.影响分裂能的因素 有配体的性质、中心原子的氧化值和中心原子的半径。 (1)配体的场强愈大,分裂能愈大。正八面体配合物的光谱实验得出的配 体场强由弱到强顺序: I -<Br-<Cl-<SCN-<F -<S2O3 2-<OH-≈ONO-<C2O4 2-<H2O<NCS-≈ EDTA<NH3<en<SO3 2-<NO2 - <<CN-<CO (2)中心原子的氧化值 中心原子的氧化值愈高,分裂能愈大

(3)中心原子的半径分裂能随中心原子半径的增大而增大。另外,配合物的几何构型不同则晶体场分裂能大小明显不同。(三)八面体场中中心原子的d电子排布轨道中已排一个电子,另一个电子进入而成对时,必须提供能量克服电子间的排斥,这种能量称为电子成对能(P)。中心原子为dl~d3及d8~dlo电子组态时,无论强场还是弱场配体,只有一种排布方式。d4~d7电子组态时,强场的A。>P,d电子尽可能填充能量较低的d,能级各轨道,称为低自旋;弱场的A。<P,d电子尽可能分占d。和d能级各轨道,称为高自旋。高自旋配合物的单电子数多于低自旋配合物。(四)晶体场稳定化能d电子进入分裂后的d轨道与分裂前(在球形场中)相比,系统总能量的降低称为晶体场稳定化能,简称CFSE。正八面体配合物的CFSE可按下式计算:CFSE=xE(d.)+yE (d)+(n2-ni) P(五)d-d跃迁和配合物的颜色(略)第三节配位平衡一、配位平衡常数以[Cu(NH3)412+为例,它在水溶液中存在着下列平衡:Cu2++4NH3[Cu(NH3)4P+平衡常数Ks称为稳定常数:[Cu(NH,)t]K=[Cu?*[NH,]二、配位平衡的移动(一)酸度的影响配合物中很多配体是碱,可接受质子。增大溶液酸度可使配位平衡向解离方向移动,这种作用称为酸效应。酸度愈大,或配体碱性愈强,酸效应就愈强烈。中心原子与OH结合而使配离子解离,叫做水解作用。溶液碱性愈强,愈有
(3)中心原子的半径 分裂能随中心原子半径的增大而增大。 另外,配合物的几何构型不同则晶体场分裂能大小明显不同。 (三)八面体场中中心原子的 d 电子排布 轨道中已排一个电子,另一个电子进入而成对时,必须提供能量克服电子间 的排斥,这种能量称为电子成对能(P)。中心原子为 d 1~d 3 及 d 8~d 10 电子组态 时,无论强场还是弱场配体,只有一种排布方式。d 4~d 7 电子组态时,强场的 Δo >P,d 电子尽可能填充能量较低的 d 能级各轨道,称为低自旋;弱场的 Δo<P, d 电子尽可能分占 d 和 dγ 能级各轨道,称为高自旋。高自旋配合物的单电子数 多于低自旋配合物。 (四)晶体场稳定化能 d 电子进入分裂后的 d 轨道与分裂前(在球形场中)相比,系统总能量的降 低称为晶体场稳定化能,简称 CFSE。正八面体配合物的 CFSE 可按下式计算: CFSE = xE ( d ) + yE (dγ) + (n2-n1) P (五)d-d 跃迁和配合物的颜色 (略) 第三节 配位平衡 一、配位平衡常数 以[Cu(NH3)4] 2+为例,它在水溶液中存在着下列平衡: Cu2+ + 4NH3 [Cu(NH3)4] 2+ 平衡常数 KS 称为稳定常数: 4 3 2 2 3 4 s [Cu ][NH ] [Cu(NH ) ] + + K = 二、配位平衡的移动 (一)酸度的影响 配合物中很多配体是碱,可接受质子。增大溶液酸度可使配位平衡向解离方 向移动,这种作用称为酸效应。酸度愈大,或配体碱性愈强,酸效应就愈强烈。 中心原子与 OH-结合而使配离子解离,叫做水解作用。溶液碱性愈强,愈有

利于水解。(二)沉淀平衡的影响向配位平衡系统加入较强沉淀剂,可使配位平衡转化为沉淀平衡。同样,向沉淀平衡系统加入较强的配位剂,可使沉淀平衡转化为配位平衡。(三)与氧化还原平衡的关系氧化还原平衡可破坏配位平衡,配位平衡也可影响氧化还原平衡。(四)其他配位平衡的影响向配位平衡系统加入更强配位剂,可使原来配离子转变成更稳定的配离子。第四节螯合物和螯合滴定一、螯合效应中心原子与多齿配体形成具有环状结构的配合物称为螯合物。由于生成螯合物而使配合物稳定性大大增加的作用称为鳌合效应。二、影响螯合物稳定性的因素1.螯合环的大小五元环和六元环的螯合物最稳定。2.环的数目螯环愈多,螯合物就愈稳定。三、生物配体(略)第五节配合物在医学上的应用(略)难题解析例11-1(1)根据价键理论,画出[Cd(NH3)4)2+(u=0μB)和[Co(NH3)6)2+(u=3.87μB)的中心原子与配体成键时的电子排布,并判断空间构型。(2)已知[Co(NH3)613-的分裂能A。为273.9kJ·mol-",Co3+的电子成对能P为251.2kJ-mol-";[Fe(H20O)P+分裂能△。为124.4kJ·molFe2+的电子成对能P为179.40kJmol-。根据晶体场理论,判断中心原子的d电子组态和配离子自旋状态。并计算晶体场稳定化能。析(1)利用磁矩确定未成对电子数,然后确定内轨或外轨及杂化类型。(2)比较分裂能与电子成对能,确定高自、自旋化合物,计算晶体场稳定化能
利于水解。 (二)沉淀平衡的影响 向配位平衡系统加入较强沉淀剂,可使配位平衡转化为沉淀平衡。同样,向 沉淀平衡系统加入较强的配位剂,可使沉淀平衡转化为配位平衡。 (三)与氧化还原平衡的关系 氧化还原平衡可破坏配位平衡,配位平衡也可影响氧化还原平衡。 (四)其他配位平衡的影响 向配位平衡系统加入更强配位剂,可使原来配离子转变成更稳定的配离子。 第四节 螯合物和螯合滴定 一、螯合效应 中心原子与多齿配体形成具有环状结构的配合物称为螯合物。由于生成螯合 物而使配合物稳定性大大增加的作用称为螯合效应。 二、影响螯合物稳定性的因素 1.螯合环的大小 五元环和六元环的螯合物最稳定。 2.环的数目 螯环愈多,螯合物就愈稳定。 三、生物配体 (略) 第五节 配合物在医学上的应用 (略) 难题解析 例 11-1(1)根据价键理论,画出[Cd(NH3)4] 2+(μ=0μB)和[Co(NH3)6] 2+(μ=3.87μB) 的中心原子与配体成键时的电子排布,并判断空间构型。(2)已知[Co(NH3)6] 3+ 的分裂能 Δo 为 273.9kJ·mol-1,Co3+的电子成对能 P 为 251.2kJ·mol-1;[Fe(H2O)6] 2+ 分裂能 Δo 为 124.4kJ·mol-, Fe2+的电子成对能 P 为 179.40kJ·mol-1。根据晶体场理 论,判断中心原子的 d 电子组态和配离子自旋状态。并计算晶体场稳定化能。 析 (1)利用磁矩确定未成对电子数,然后确定内轨或外轨及杂化类型。(2) 比较分裂能与电子成对能,确定高自、自旋化合物,计算晶体场稳定化能

解(1)[Cd(NH3)4P+中Cd2+的电子组态为4d10,μ=OuB,无未成对电子,采取sp3杂化轨道成键,配体NHs中N的孤电子对填入sp3杂化轨道,配离子空间构型为正四面体。4dsp3杂化外轨配离子[Cd(NH3)4 ]2+[Kr]↑电子由NH中N提供[Co(NH3)P2+中Co2+的电子组态为3d7,μ=3.87uB,利用μ=n(n-1)μg,未成对电子数n=3,故以sp3d2杂化轨道成键,NH3中N的孤电子对填入p3d?杂化轨道,属外轨配合物,正八面体构型。3d4dspd2杂化三+++[Co(NH3)6]2+ [Ar]电子由NH中N提供外轨配离子(2)[Co(NH3)J3+中Co3+的电子组态为3d6,A>P,属低自旋配合物。电子排布为dd,晶体场稳定化能为CFSE=xE(d,)+yE (d)+(n2-nl)P=6x(-0.4△o)+0×0.6△。)+(3-1)P=-155.1 kJ-mol-1[Fe(H2O)sP+中Fe2+的电子组态为3d6,电子排布为d,d’,A<P,属高自旋配合物。晶体场稳定化能为CFSE=xE(d,)+yE (d)+(m2-n)P=4× (-0.4△) +2×0.6△。)+(1-1) P=-49.8 kJ-mol-1例11-2固体CrCl3·6H20的化学式可能为(Cr(H20)4Ch)C1-2H20或(Cr(H2O)C1)C1H2O或(Cr(H2O))Cl3,今将溶解有0.200gCrCl36H2O的溶液流过一酸性阳离子交换柱,在柱上进行离子交换反应:Xn+(aq)nHt(aq)+n(RSO3H)(RSO3)nX+阳离子交换树脂交换下来的H*配合物正离子交换后的交换树脂交换下来的H+用0.100mol-L-INaOH标准溶液滴定,计耗去22.50mL,通过计算
解 (1)[Cd(NH3)4] 2+中 Cd2+的电子组态为 4d10,μ=0μB,无未成对电子, 采取 sp3 杂化轨道成键,配体 NH3 中 N 的孤电子对填入 sp3 杂化轨道,配离子空 间构型为正四面体。 4d sp3 杂化 [Cd(NH3)4] 2+ [Kr] 外轨配离子 电子由 NH3 中 N 提供 [Co(NH3)6] 2+中 Co2+的电子组态为 3d7,μ=3.87μB,利用 B = n(n −1) ,未 成对电子数 n=3,故以 sp3d 2 杂化轨道成键,NH3 中 N 的孤电子对填入 sp3d 2 杂化 轨道,属外轨配合物,正八面体构型。 3d sp3d 2 杂化 4d 电子由 NH3 中 N 提供 外轨配离子 (2)[Co(NH3)6] 3+中 Co3+的电子组态为 3d6,Δo>P,属低自旋配合物。电 子排布为 6 0 dd ,晶体场稳定化能为 CFSE = xE ( d ) + yE (dγ) + (n2-n1) P =6×(-0.4Δo)+ 0×0.6Δo)+ (3-1)P =-155.1 kJ·mol-1 [Fe(H2O)6] 2+中 Fe2+的电子组态为 3d6,电子排布为 4 2 dd ,Δo<P,属高自旋 配合物。晶体场稳定化能为 CFSE = xE ( d ) + yE (dγ) + (n2-n1) P =4×(-0.4Δo)+ 2×0.6Δo)+(1-1)P =-49.8 kJ·mol-1 例 11-2 固体 CrCl3·6H2O 的化学式可能为〔Cr(H2O)4Cl2〕Cl·2H2O 或 〔Cr(H2O)5Cl〕Cl·H2O 或〔Cr(H2O)6〕Cl3,今将溶解有 0.200gCrCl3·6H2O 的溶 液流过一酸性阳离子交换柱,在柱上进行离子交换反应: Xn+(aq) + n(RSO3H) (RSO3)nX + nH+ (aq) 配合物正离子 阳离子交换树脂 交换后的交换树脂 交换下来的 H + 交换下来的 H+用 0.100mol·L-1NaOH 标准溶液滴定,计耗去 22.50mL,通过计算 [Co(NH3)6] 2+ [Ar]

推断上述配合物的正确化学式(已知Mr(CrCl3-6H2O)=266.5)。析:根据题中条件可知离子的物质的量与配合物的电荷数有确定的关系,因此只要确定离子的物质的量即可求出配离子的电荷,进而求出配合物的化学式。解0.200gCrCl3·6H20的物质的量为0.200g—x1000mmol =0.75mmol266.5g·mol-1*—Imol滴定测得n(H+)=22.50mL×0.100mol-L-l=2.25mmol由交换反应式知:1molXn+可交换出nmolH+。因0.75mmolCrCl36H20O交换出2.25mmol的H+,由此可得1:n=0.75:2.25n=3即X+为X3+,所以配正离子只能是[Cr(H2O)]3+,配合物为[Cr(H2O)6]Cl3。例11-3将0.20mol-L-l的AgNO3溶液与0.60mol-L-l的KCN溶液等体积混合后,加入固体KI(忽略体积的变化),使I-浓度为0.10molL-l,问能否产生Agl沉淀?溶液中CN-浓度低于多少时才可出现Agl沉淀?析只要求出生成离子[Ag(CN)2}后溶液中剩余的Ag+离子浓度与I-离子浓度的乘积即离子积,通过比较离子积与溶度积的大小即可。解等体积混合后[Ag*}=0.20mol-L-1×1/2=.0.10mol-L-1[CN-]=0.60mol-L-1×1/2=.0.30mol-L-1Ag+2CN-[Ag(CN)2]0 mol-L-1反应前的浓度0.10molL-0.30mol-L-1平衡时浓度xmol-L-1(0.30-0.20+2x)mol-L-l(0.10-x) mol-L-l~0.10molL-1~0.10mol-L-l10.10mol-L-1[Ag(CN)]]=7.69x10-21mol-L-[Ag]-Ks([Ag(CN),)[CN-}1.3 ×102′ ×(0.10mol-L)有 Q=[Ag*I[I-}=7.69×10-21mol-L-1×0.10mol-L-1=7.69×10-22<Ksp(Agl)=8.52×10-17无Agl沉淀生成。若要在[I-1=0.10mol-L-l的条件下形成Agl沉淀,则溶液中Ag+浓度为:[Ag*}Kg = 8.52×10-17 = 8.52×10-16 mol L-[1]0.10mol-L-]
推断上述配合物的正确化学式〔已知 Mr(CrCl3·6H2O)=266.5〕。 析 根据题中条件可知离子的物质的量与配合物的电荷数有确定的关系,因 此只要确定离子的物质的量即可求出配离子的电荷,进而求出配合物的化学式。 解 0.200gCrCl3•6H2O 的物质的量为 1mol 1000mmol 266.5g mol 0.200g 1 − =0.75mmol 滴定测得 n(H+ )=22.50mL×0.100mol·L-1=2.25mmol 由交换反应式知:1mol Xn+可交换出 nmol H+。因 0.75 mmol CrCl3•6H2O 交 换出 2.25 mmol 的 H+,由此可得 1 :n = 0.75 :2.25 n = 3 即 Xn+为 X3+,所以配正离子只能是[Cr(H2O)6] 3+,配合物为[Cr(H2O)6]Cl3。 例 11-3 将 0.20mol·L-1 的 AgNO3 溶液与 0.60mol·L-1 的 KCN 溶液等体积混 合后,加入固体 KI(忽略体积的变化),使 I -浓度为 0.10mol·L-1,问能否产生 AgI 沉淀?溶液中 CN-浓度低于多少时才可出现 AgI 沉淀? 析 只要求出生成离子[Ag(CN)2] -后溶液中剩余的 Ag+离子浓度与 I -离子浓 度的乘积即离子积,通过比较离子积与溶度积的大小即可。 解 等体积混合后 [Ag+ ]=0.20mol·L-1×1/2=.0.10mol·L-1 [CN- ]= 0.60mol·L-1×1/2=.0.30mol·L-1 Ag+ + 2CN- [Ag(CN)2] - 反应前的浓度 0.10mol·L-1 0.30mol·L-1 0 mol·L-1 平衡时浓度 xmol·L-1 (0.30-0.20+2x)mol·L-1 (0.10-x)mol·L-1 ≈0.10mol·L-1 ≈0.10mol·L-1 [Ag+ ]= 2 2 2 {[Ag(CN) ] }[CN ] [Ag(CN) ] − − − KS = 21 i 2 1 1.3 10 (0.10mol L ) 0.10mol L − − =7.69×10-21mol·L- 有 Q=[Ag+ ][I- ]=7.69×10-21mol·L-1×0.10mol·L-1=7.69×10-22<Ksp(AgI)=8.52×10-17 无 AgI 沉淀生成。 若要在[I- ]=0.10mol·L-1 的条件下形成 AgI 沉淀,则溶液中 Ag+ 浓度为: [Ag+ ]> [I ] sp − K = 16 1 1 17 8.52 10 mol L 0.10mol L 8.52 10 − − − − =

[Ag(CN)]0.10mol-L-l[CN-]V18.52×10-x1303.0×10molV[Ag']xKs由计算可知,要使上述溶液生成AgI沉淀,必须使[CN-K<3.0x10-4mol-L-l例11-4已知p(Ag*/Ag)=0.7996V,Ksp=5.38×10-13,p([Ag(S,0,),]*/Ag)=0.017V,计算[Ag(S2O3)2]3-的Ks。若使0.10molAgBr(s)完全溶解在1.0LNa2S203溶液中,则Na2S203溶液的最初浓度应为多少?析:利用电极电位与平衡常数的关系求[Ag(S2O3)2J3-的稳定常数;利用Ksp(AgBr)与 Ks([Ag(S203)2]3-)求反应 AgBr +2S2O32--[Ag(S203)2]3-+Br的标准平衡常数K。解p([Ag(S,O,),]-/Ag) =p(Ag*/Ag)- 0.05916lg Ks([Ag(S203)2]3-)Ig Ks[Ag(S20:)]P-)=2 (Ag /Ag) -0'(Ag(S, 0,),)- /Ag)0.05916V_0.7996V-0.017V=13.22850.05916VKs([Ag(S203)2]3-)=1.69×1013若使AgBr(s)完全溶解在Na2S2O3溶液中,设溶液的最初浓度为xmolL-1AgBr+ 2S2032-[Ag(S203)2J3- + Br开始浓度/mol-L-1x-2×0.100.100.10平衡浓度/mol-L-1(x-2×0.10+2y)0.10-y0.10-y=x-2×0.10~0.10~0.10KBrS)=K(AgB)K(Ag(S,O,))[S,0′-]=5.38×10-13×1.69×1013=9.090.10mol-L-×0.10mol.L-lK即9.09[(x-2×0.10)mol·L-"}x=0.2332相关知识介绍
[CN- ]= S 2 [Ag ] [Ag((CN) ] K + − = 4 1 16 21 1 3.0 10 mol L 18.52 10 1.3 10 0.10mol L − − − − = 由计算可知,要使上述溶液生成 AgI 沉淀,必须使[CN- ]<3.0×10-4mol·L-1 . 例 11-4 已知 (Ag /Ag) θ + =0.7996V,Ksp=5.38×10-13, ([Ag(S O ) ] /Ag) 3- 2 3 2 θ =0.017V,计算[Ag(S2O3)2] 3-的 KS。若使 0.10molAgBr(s)完全溶解在 1.0LNa2S2O3 溶液中,则 Na2S2O3 溶液的最初浓度应为多少? 析 利用电极电位与平衡常数的关系求[Ag(S2O3)2] 3-的稳定常数;利用 Ksp(AgBr)与 KS([Ag(S2O3)2] 3- )求反应 AgBr + 2S2O3 2- [Ag(S2O3)2] 3- + Br-的 标准平衡常数 K。 解 ([Ag(S O ) ] /Ag) 3- 2 3 2 θ = (Ag /Ag) θ + - 0.05916lg KS([Ag(S2O3)2] 3- ) lg KS([Ag(S2O3)2] 3- )= 0.05916V (Ag /Ag) ([Ag(S O ) ] /Ag) 3 2 3 2 θ + θ − − = 13.2285 0.05916V 0.7996V 0.017V = − Ks([Ag(S2O3)2] 3- ) =1.69×1013 若使 AgBr(s)完全溶解在 Na2S2O3 溶液中,设溶液的最初浓度为 x mol·L-1 AgBr + 2S2O3 2- [Ag(S2O3)2] 3- + Br- 开始浓度/mol·L-1 x-2×0.10 0.10 0.10 平衡浓度/mol·L-1 (x-2×0.10+2y) 0.10- y 0.10- y ≈x-2×0.10 ≈0.10 ≈0.10 2 2 2 3 3 2 3 2 [S O ] [Br ][Ag(S O ) ] − − − K = (AgBr) ([Ag(S O ) ] ) 3 sp s 2 3 2 − = K K =5.38×10-13×1.69×1013 =9.09 即 9.09 [( 2 0.10)mol L ] 0.10mol L 0.10mol L 1 2 1 1 = − = − − − x K x =0.2332 相关知识介绍

《基础化学(第六版)》习题解答1.(1)配合物的内层由中心原子提供杂化轨道,配体中配位原子提供孤对电子,通过配位键形成的配离子。与配离子带相反电荷的离子称为配合物的外层。(2)只含有一个配位原子的配体称为单齿配体,如NH3,H2O,OH,F-等。含有两个或两个以上配位原子的配体称为多齿配体,如:乙二胺,EDTA等。(3)配离子[Fe(CN)6J3-的Fe3+以2个3d轨道、1个4s轨道和3个4p轨道杂化形成6个杂化轨道,称为dsp3杂化。配离子[FeF63-的Fe3+以1个4s轨道、3个4p轨道和2个4d轨道杂化形成6杂化轨道,称为sp3d2杂化。(4)中心原子全部用最外层轨道杂化所形成的配合物称为外轨配合物;用次外层d轨道和最外层ns,np轨道杂化所形成的配合物称为内轨配合物。(5)依据配体使中心原子d轨道能级的分裂程度不同,配体有强场、弱场之分。使d轨道能级分裂能力强的配体称为强场配体,如CN,CO;使d轨道能级分裂能力弱的配体称为弱场配体,如H2O、F、CI、Br、I。(6)中心原子电子组态为d4~d7的配合物中,单电子数多的称为高自旋配合物,单电子数少的称为低自旋配合物。强场配体形成低自旋配合物,弱场配体形成高自旋配合物。2.名称中心原子配体配位原子配位数2S20;2-(1)二(硫代硫酸根)合银(I)酸钠Ag*S20,2-中的S6Co3+(2)enen中的N硫酸三(乙二胺)合钴(II)A13+4(3)OHOH中的O四羟基合铝(II)酸F-6(4)Si(IV)F中的F六氟合硅(IV)酸钠6Pt4+(5)五氯氨合铂(IV)离子CI, NCI,NH36Pt2+(6)NO2,CI,NH3N,CI、N氯硝基四氨合铂(II)6Co3+(7)氯化二氯三氨水合钴(II)CI,NH3,H20Cl,N,O6Cr3+N, N四(异硫氰酸根)二氨合铬(II)酸铵NCS-,NH3(8)3.由中心原子与多齿配体形成有环状结构的配合物称为螯合物。鳌合物的特点是稳定、溶解度大。鳌合物稳定性与鳌合环的数目和大小有关,一般以五元环、六元环最为稳定,螯环越多的鳌合物越稳定。形成五员环和六员环的鳌合物
《基础化学(第六版)》习题解答 1.(1)配合物的内层由中心原子提供杂化轨道,配体中配位原子提供孤对 电子,通过配位键形成的配离子。与配离子带相反电荷的离子称为配合物的外层。 (2)只含有一个配位原子的配体称为单齿配体,如 NH3,H2O,OH -,F - 等。含有两个或两个以上配位原子的配体称为多齿配体,如:乙二胺,EDTA 等。 (3)配离子[Fe(CN)6] 3-的 Fe3+以 2 个 3d 轨道、1 个 4s 轨道和 3 个 4p 轨道 杂化形成 6 个杂化轨道,称为 d 2 sp3 杂化。配离子[FeF6] 3-的 Fe3+以 1 个 4s 轨道、 3 个 4p 轨道和 2 个 4d 轨道杂化形成 6 杂化轨道,称为 sp3d 2 杂化。 (4)中心原子全部用最外层轨道杂化所形成的配合物称为外轨配合物;用 次外层 d 轨道和最外层 ns,np 轨道杂化所形成的配合物称为内轨配合物。 (5)依据配体使中心原子 d 轨道能级的分裂程度不同,配体有强场、弱场 之分。使 d 轨道能级分裂能力强的配体称为强场配体,如 CN-,CO;使 d 轨道 能级分裂能力弱的配体称为弱场配体,如 H2O、F -、Cl-、Br-、I -。 (6)中心原子电子组态为 d 4~d 7 的配合物中,单电子数多的称为高自旋配 合物,单电子数少的称为低自旋配合物。强场配体形成低自旋配合物,弱场配体 形成高自旋配合物。 2. 名 称 中心原子 配 体 配位原子 配位数 (1) 二(硫代硫酸根)合银(I)酸钠 Ag+ S2O3 2- S2O3 2- 中的 S 2 (2) 硫酸三(乙二胺)合钴(Ⅲ) Co3+ en en 中的 N 6 (3) 四羟基合铝(Ⅲ)酸 Al3+ OH- OH- 中的 O 4 (4) 六氟合硅(Ⅳ)酸钠 Si(Ⅳ) F - F - 中的 F 6 (5) 五氯氨合铂(Ⅳ)离子 Pt4+ Cl- ,NH3 Cl,N 6 (6) 氯硝基四氨合铂(Ⅱ) Pt2+ NO2 - ,Cl- ,NH3 N,Cl、N 6 (7) 氯化二氯三氨水合钴(Ⅲ) Co3+ Cl- ,NH3,H2O Cl,N,O 6 (8) 四(异硫氰酸根)二氨合铬(Ⅲ)酸铵 Cr3+ NCS- ,NH3 N,N 6 3. 由中心原子与多齿配体形成有环状结构的配合物称为螯合物。螯合物的 特点是稳定、溶解度大。螯合物稳定性与螯合环的数目和大小有关,一般以五元 环、六元环最为稳定,螯环越多的螯合物越稳定。形成五员环和六员环的螯合物

的配体必须具有2个或2个以上配位原子,配位原子之间应该间隔2个或3个其他原子,以形成稳定的五元环或六元环。4.(1)不对。中性配位分子只有内层,没有外层;(2)不对。某些高氧化态非金属元素的原子也能作中心原子形成配合物。(3)不对。配合物中多齿配体的数目不等于中心原子的配位数:(4)不对。当有阴离子配体时,配离子电荷数不等于中心原子的电荷数;(5)正确;(6)不对。中心原子只有在形成配合物前d电子组态相同时,外轨配合物比形成的内轨配合物的磁矩大;(7)正确。中心原子的d电子在高自旋配合物中优先以平行自旋分占d能级和de能级各轨道,而在低自旋配合物中优先占据de能级各轨道,获得更大晶体场稳定化能。5.平面四方形结构的[PdCl4]2-的Pd原子轨道为dsp?杂化,4d5s5pT..[PdC14]2- [Kr]Vdsp?杂化磁矩μ=n(n+2)=/0×(0+2)=0μB,具有抗磁性。四面体结构的[Cd(CN)4]-的Cd原子轨道为sp3杂化,4d5s5p..[Cd(CN)4}-[Kr] Ysp杂化磁矩μ=n(n+2)=ox(0+2=0μg,具有抗磁性。6.(1)Co2+为3d7电子排布,由磁矩可知有3个单电子,2对电子对,因此为sp3d?杂化,[Co(en)3P+的空间构型为正八面体,外轨配合物。(2)Fe3+为3d5电子排布,由磁矩可知有5个单电子,分布在5个3d轨道上,因此为Sp3d2杂化,[Fe(C2O4)33-的空间构型为正八面体,外轨配合物(3)Co3+为3d6电子排布,由磁矩可知单电子数为0,3对电子分布在3个d轨道上。因此为dsp杂化,[Co(en)2Ch]CI的空间构型为正八面体,内轨配合物
的配体必须具有 2 个或 2 个以上配位原子,配位原子之间应该间隔 2 个或 3 个其 他原子,以形成稳定的五元环或六元环。 4. (1)不对。中性配位分子只有内层,没有外层; (2)不对。某些高氧化态非金属元素的原子也能作中心原子形成配合物。 (3)不对。配合物中多齿配体的数目不等于中心原子的配位数; (4)不对。当有阴离子配体时,配离子电荷数不等于中心原子的电荷数; (5)正确; (6)不对。中心原子只有在形成配合物前 d 电子组态相同时,外轨配合物比 形成的内轨配合物的磁矩大; (7)正确。中心原子的 d 电子在高自旋配合物中优先以平行自旋分占 dγ 能级 和 dε 能级各轨道,而在低自旋配合物中优先占据 dε 能级各轨道,获得更大晶体 场稳定化能。 5. 平面四方形结构的[PdCl4] 2-的 Pd 原子轨道为 dsp2杂化, [PdCl4] 2- [Kr] 磁矩 n n 0 2 0 B = ( + 2) = 0( + )= ,具有抗磁性。 四面体结构的[Cd(CN)4] 2-的 Cd 原子轨道为 sp3杂化, 4d 5s 5p [Cd(CN)4] 2- [Kr] sp3 杂化 磁矩 n n 0 2 0 B = ( + 2) = 0( + = ,具有抗磁性。 6. (1)Co2+为 3d7 电子排布,由磁矩可知有 3 个单电子,2 对电子对,因此为 sp3d 2 杂化,[Co(en)3] 2+的空间构型为正八面体,外轨配合物。 (2)Fe3+为 3d5 电子排布,由磁矩可知有 5 个单电子,分布在 5 个 3d 轨道上, 因此为 sp3d 2 杂化,[Fe(C2O4)3] 3-的空间构型为正八面体,外轨配合物。 (3)Co3+为 3d6 电子排布,由磁矩可知单电子数为 0,3 对电子分布在 3 个 d 轨道上。因此为 d 2 sp3 杂化,[Co(en)2Cl2]Cl 的空间构型为正八面体,内轨配合物。 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ·· ·· ·· ·· ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ·· ·· ·· ·· 4d 5s 5p dsp2 杂化
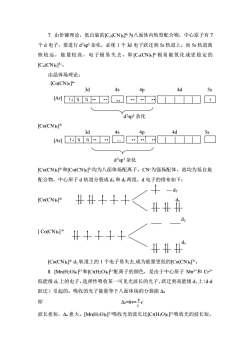
7.由价键理论,低自旋的[Co(CN)6-为八面体内轨型配合物,中心原子有7个d电子,要进行dsp杂化,必使1个3d电子跃迁到5s轨道上,而5s轨道离核较远,能量较高,电子极易失去,即[Co(CN)}+极易被氧化成更稳定的[Co(CN)6]3-。由晶体场理论:[Co(CN)6]4-3d4s4d4p5s[Arl+dsp3杂化[Co(CN)6]3-3d4s4p4d5s[Ar CYdsp3杂化[Co(CN)6]-和[Co(CN)J3-均为八面体场配离子,CN-为强场配体,故均为低自旋配合物,中心原子d轨道分裂成de和d两组,d电子的排布如下:dy##++[Co(CN)6 ]4-d+:dy[Co(CN)6]3--d≠扌[Co(CN)]4-d,轨道上的1个电子易失去,成为能量更低的[Co(CN)3-。8.[Mn(H2O)6]2+和[Cr(H2O)P+配离子的颜色,是由于中心原子Mn2+和Cr2+低能级de上的电子,选择性吸收某一可见光波长的光子,跃迁到高能级d上(d-d跃迁)引起的。吸收的光子能量等于八面体场的分裂能。Ao=hv=hc即4波长愈短,A。愈大。[Mn(H2O)]2+吸收光的波长比[Cr(H2O)]2+吸收光的波长短
7. 由价键理论,低自旋的[Co(CN)6] 4-为八面体内轨型配合物,中心原子有 7 个 d 电子,要进行 d 2 sp3 杂化,必使 1 个 3d 电子跃迁到 5s 轨道上,而 5s 轨道离 核较远,能量较高,电子极易失去,即[Co(CN)6] 4-极易被氧化成更稳定的 [Co(CN)6] 3-。 由晶体场理论: [Co(CN)6] 4- 3d 4s 4p 4d 5s [Ar] d 2 sp3 杂化 [Co(CN)6] 3- 3d 4s 4p 4d 5s [Ar] d 2 sp3 杂化 [Co(CN)6] 4-和[Co(CN)6] 3-均为八面体场配离子,CN-为强场配体,故均为低自旋 配合物,中心原子 d 轨道分裂成 dε 和 dγ 两组,d 电子的排布如下: — dγ [Co(CN)6] 4- dε dγ [ Co(CN)6] 3- dε [Co(CN)6] 4- dγ 轨道上的 1 个电子易失去,成为能量更低的[Co(CN)6] 3-。 8. [Mn(H2O)6] 2+和[Cr(H2O)6] 2+配离子的颜色,是由于中心原子 Mn2+和 Cr2+ 低能级 dε 上的电子,选择性吸收某一可见光波长的光子,跃迁到高能级 dγ 上(d-d 跃迁)引起的。吸收的光子能量等于八面体场的分裂能 Δo 即 Δo=hν= λ h c 波长愈短,Δo 愈大。[Mn(H2O)6] 2+吸收光的波长比[Cr(H2O)6] 2+吸收光的波长短, ↑↓↑↓ ↑↓ ·· ·· ·· ·· ·· ·· ↑ ↑↓↑↓ ↑↓ ·· ·· ·· ·· ·· ··
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《医学有机化学》课程学习指导(医用基础化学)第八章 氧化还原反应与电极电位(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十章 共价键与分子间力(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)综合测试题(无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十二章 滴定分析(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十四章 现代仪器分析简介(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十三章 可见分光光度法和紫外分光光度法(含测试,无答案).doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-1-实验指导-基础部分.doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-1-实验指导-无机实验.doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-2-实验指导-有机化学实验(共十九个实验).doc
- 《医学有机化学》课程教学资源(授课教案)有机化学实验教案2010-2011学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)医学有机化学教案2010-2011学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)医用基础化学实验2011-2012学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)医用基础化学教案2011-2012学年第一学期.doc
- 《医学有机化学实验》课程教学大纲 Organic chemistry.doc
- 《医用基础化学实验》课程教学大纲.doc
- 《医学有机化学》课程教学大纲 Medicinal Organic Chemistry.doc
- 《医用基础化学》课程教学大纲 Medic Basis Chemistry.doc
- 《实验化学》课程教学课件(PPT讲稿)粗食盐的提纯.ppt
- 《实验化学》课程教学课件(PPT讲稿)醋酸电离度和电离常数的测定.ppt
- 《实验化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《医学有机化学》课程学习指导(医用基础化学)第九章 原子结构和元素周期律(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第五章 胶体溶液(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第七章 化学反应速率(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第四章 缓冲溶液(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第六章 化学反应热及化学反应的方向和限度(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第一章 绪论(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第三章 电解质溶液(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第二章 稀溶液的依数性(含测试,无答案).doc
- 《医学有机化学》课程学习指导(知识要点)第13章 脂类.pdf
- 《医学有机化学》课程学习指导(知识要点)第14章 氨基酸、蛋白质和核酸.pdf
- 《医学有机化学》课程学习指导(知识要点)第11章 芳香杂环化合物.pdf
- 《医学有机化学》课程学习指导(知识要点)第09章 立体异构.pdf
- 《医学有机化学》课程学习指导(知识要点)第10章 含氮有机化合物.pdf
- 《医学有机化学》课程学习指导(知识要点)第08章 羟基酸和酮酸.pdf
- 《医学有机化学》课程学习指导(知识要点)第12章 糖类.pdf
- 《医学有机化学》课程学习指导(知识要点)第04章 卤代烃.pdf
- 《医学有机化学》课程学习指导(知识要点)第05章 醇酚醚.pdf
- 《医学有机化学》课程学习指导(知识要点)第07章 羧酸及其衍生物.pdf
- 《医学有机化学》课程学习指导(知识要点)第06章 醛酮醌.pdf
- 《医学有机化学》课程学习指导(知识要点)第01章 绪论.pdf
