《医学有机化学》课程学习指导(医用基础化学)第十章 共价键与分子间力(含测试,无答案)

第十章共价键与分子间力内容提要第一节现代价键理论一、氢分子的形成氢分子的形成是两个氢原子互相靠近,两个单电子自旋相反,两个1s轨道重叠,形成稳定共价键的结果,称为氢分子的基态。如果两个单电子自旋相同,轨道重叠部分互相抵消,不能成键,称为氢分子的排斥态。共价键的本质是电性的,但不同于一般静电作用,其结合力是两核间的电子云密集区对核的吸引力。二、现代价键理论①成键两个原子各提供一个自旋相反的单电子配对,两原子轨道重叠,使电子云密集于两核间,系统能量降低,形成稳定共价键。②单电子配对形成共价键后,就不能再和其他单电子配对。所以每个原子所形成共价键的数目取决于该原子中的单电子数目。这就是共价键的饱和性。③成键的原子轨道相互尽可能最大程度重叠,决定了共价键的方向性。三、共价键的类型按原子轨道重叠方式,沿键轴方向,以“头碰头”方式重叠形成的共价键称为α键,S-S、S-px、px-px轨道之间可以形成α键;以"肩并肩"方式重叠形成的共价键称为Ⅱ键,py-py、pz-pz轨道之间可以形成几键。α键的轨道重叠程度比元键大,因而键比元键牢固。6键是构成分子的骨架,可单独存在于两原子间。根据成键电子来源,成键两原子各提供1个电子配对形成的共价键称为正常共价键,一个原子单独提供电子对进入另一个原子的空轨道形成的共价键为配位键。四、键参数描述共价键性质的参数有键能、键长、键角、键的极性等。键能是衡量
第十章 共价键与分子间力 内容提要 第一节 现代价键理论 一、氢分子的形成 氢分子的形成是两个氢原子互相靠近,两个单电子自旋相反,两个 1s 轨道重叠,形成稳定共价键的结果,称为氢分子的基态。如果两个单电子自 旋相同,轨道重叠部分互相抵消,不能成键,称为氢分子的排斥态。共价键 的本质是电性的,但不同于一般静电作用,其结合力是两核间的电子云密集 区对核的吸引力。 二、现代价键理论 ①成键两个原子各提供一个自旋相反的单电子配对,两原子轨道重叠, 使电子云密集于两核间,系统能量降低,形成稳定共价键。②单电子配对形 成共价键后,就不能再和其他单电子配对。所以每个原子所形成共价键的数 目取决于该原子中的单电子数目。这就是共价键的饱和性。③成键的原子轨 道相互尽可能最大程度重叠,决定了共价键的方向性。 三、共价键的类型 按原子轨道重叠方式,沿键轴方向,以“头碰头”方式重叠形成的共价键 称为 σ 键,s-s、s-px、px-px 轨道之间可以形成 σ 键;以“肩并肩”方式重叠 形成的共价键称为 л 键,py-py、pz-pz 轨道之间可以形成 л 键。σ 键的轨道 重叠程度比 π 键大,因而 σ 键比 π 键牢固。σ 键是构成分子的骨架,可单独 存在于两原子间。 根据成键电子来源,成键两原子各提供 1 个电子配对形成的共价键称为 正常共价键,一个原子单独提供电子对进入另一个原子的空轨道形成的共价 键为配位键。 四、键参数 描述共价键性质的参数有键能、键长、键角、键的极性等。键能是衡量

共价键强度的物理量,键能愈大,键愈牢固。键长是成键原子间的核间距。键角为分子中同一原子形成的两个化学键间的夹角,它是反映了分子空间的构型。键的极性是指成两个成键原子的正、负电荷重心是否重合,恰好重合为非极性分子,不重合为极性分子。第二节杂化轨道理论一、杂化轨道理论的要点①成键过程中,同一原子中几个能量相近的不同类型的原子轨道进行组合,重新分配能量和空间方向,组成数目相等的新的原子轨道,称为杂化轨道。②杂化轨道更有利原子轨道间最大程度地重叠,成键能力强。③杂化轨道之间力图取最大空间夹角分布,使相互间的排斥最小。杂化轨道类型决定分子的空间构型。二、轨道杂化类型及实例根据各种杂化轨道中所含有各原子轨道成分是否相同,杂化轨道又可分为等性杂化和不等性杂化。常见的等性杂化轨道与分子几何构型的关系见表10-1。表10-1常见的杂化轨道与分子几何构型的关系杂化杂化轨杂化轨道构分子等性或不等键角分子构型实例型类型道夹角类型性杂化180°直线形180°spAB2等性直线形HgCl2,CO2,BeCl2等性120°AB;平面三角形BF3, NO3sp2120°平面三角形不等性AB2<120°V形PbCl2,SO2,CO:2等性AB4109.5°正四面体SiF4, SO42,CCl4,,PO43sp3109°28°正四面体不等性<109.5°AB3三角锥形NH, H;O+不等性<109.5°AB2V形H2O, H2S等性ABs三角双锥PCls, PFs90°不等性AB4变形四面体SF4, TeCl4sp'd三角双锥不等性120°AB3T形CIF3AB2不等性直线形I3,XeF2,SiFsAB6等性正八面体SF6,AIF.CClsp'd290°正八面体不等性ABs四方锥形BrFs,SbFs2-
共价键强度的物理量,键能愈大,键愈牢固。键长是成键原子间的核间距。 键角为分子中同一原子形成的两个化学键间的夹角,它是反映了分子空间的 构型。键的极性是指成两个成键原子的正、负电荷重心是否重合,恰好重合 为非极性分子,不重合为极性分子。 第二节 杂化轨道理论 一、杂化轨道理论的要点 ①成键过程中,同一原子中几个能量相近的不同类型的原子轨道进行组 合,重新分配能量和空间方向,组成数目相等的新的原子轨道,称为杂化轨 道。②杂化轨道更有利原子轨道间最大程度地重叠,成键能力强。③杂化轨 道之间力图取最大空间夹角分布,使相互间的排斥最小。杂化轨道类型决定 分子的空间构型。 二、轨道杂化类型及实例 根据各种杂化轨道中所含有各原子轨道成分是否相同,杂化轨道又可分 为等性杂化和不等性杂化。常见的等性杂化轨道与分子几何构型的关系见表 10-1。 表 10-1 常见的杂化轨道与分子几何构型的关系 杂化 类型 杂化轨 道夹角 杂化轨道构 型 分子 类型 等性或不等 性杂化 键角 分子构型 实 例 sp 180° 直线形 AB2 等性 180° 直线形 HgCl2, CO2,BeCl2 sp2 120° 平面三角形 AB3 AB2 等性 不等性 120° <120° 平面三角形 V 形 BF3, NO3 - PbCl2, SO2,CO3 2- sp3 109°28´ 正四面体 AB4 AB3 AB2 等性 不等性 不等性 109.5° <109.5° <109.5° 正四面体 三角锥形 V 形 SiF4, SO4 2- ,CCl4, ,PO4 3- NH3, H3O + H2O, H2S sp3d 90° 120° 三角双锥 AB5 AB4 AB3 AB2 等性 不等性 不等性 不等性 三角双锥 变形四面体 T 形 直线形 PCl5, PF5 SF4, TeCl4 ClF3 I3 - , XeF2,SiF5 - sp3d 2 90° 正八面体 AB6 AB5 等性 不等性 正八面体 四方锥形 SF6, AlF6 3- ,CCl6 BrF5 , SbF5 2-
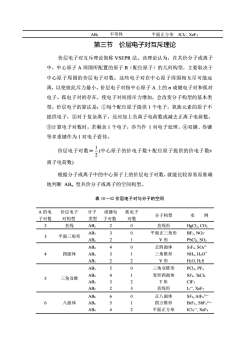
不等性AB4平面正方形ICl4XeF第三节价层电子对互斥理论价层电子对互斥理论简称VSEPR法。该理论认为,在共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要取决于中心原子周围的价层电子对数。这些电子对在中心原子周围相互尽可能远离,以使彼此斥力最小。价层电子对指中心原子A上的成键电子对和孤对电子。孤电子对的存在,使电子对间排斥力增加,会改变分子构型的基本类型。价层电子的算法是:①每个配位原子提供1个电子,氧族元素的原子不提供电子,②对于复杂离子,还应加上负离子电荷数或减去正离子电荷数,③计算电子对数时,若剩余1个电子,亦当作1对电子处理,④双键、叁键等多重键作为1对电子看待。价层电子对数=(中心原子的价电子数十配位原子提供的价电子数士2离子电荷数根据分子或离子中的中心原子上的价层电子对数,就能比较容易而准确地判断AB,型共价分子或离子的空间构型。表10-02价层电子对与分子的空间A的电价层电子分子成键电孤电子分子构型实例子对数对构型类型子对数对数2直线AB220直线形HgCl2, CO23AB30平面正三角形BF3, NO33平面三角形21AB2V形PbCl2, SO240AB4正四面体SiF4, SO,2-4四面体AB;31三角锥形NH3, H3O+22AB2V形H2O, H2SABs50三角双锥形PCls, PFs41AB4变形四面体SF4, TeCl45三角双锥32T形AB3CIF323AB2直线形I-, XeF2AB60SF6,AIF63-6正八面体156八面体ABs四方锥形BrFs,SbF,242AB4平面正方形ICl4-, XeF4
AB4 不等性 平面正方形 ICl4 - , XeF4 第三节 价层电子对互斥理论 价层电子对互斥理论简称 VSEPR 法。该理论认为,在共价分子或离子 中,中心原子 A 周围所配置的原子 B(配位原子)的几何构型,主要取决于 中心原子周围的价层电子对数。这些电子对在中心原子周围相互尽可能远 离,以使彼此斥力最小。价层电子对指中心原子 A 上的 σ 成键电子对和孤对 电子。孤电子对的存在,使电子对间排斥力增加,会改变分子构型的基本类 型。价层电子的算法是:①每个配位原子提供 1 个电子,氧族元素的原子不 提供电子,②对于复杂离子,还应加上负离子电荷数或减去正离子电荷数, ③计算电子对数时,若剩余 1 个电子,亦当作 1 对电子处理,④双键、叁键 等多重键作为 1 对电子看待。 价层电子对数= 2 1 (中心原子的价电子数+配位原子提供的价电子数± 离子电荷数) 根据分子或离子中的中心原子上的价层电子对数,就能比较容易而准确 地判断 ABn 型共价分子或离子的空间构型。 表 10-02 价层电子对与分子的空间 A 的电 子对数 价层电子 对构型 分子 类型 成键电 子对数 孤电子 对数 分子构型 实 例 2 直线 AB2 2 0 直线形 HgCl2, CO2 3 平面三角形 AB3 AB2 3 2 0 1 平面正三角形 V 形 BF3, NO3 - PbCl2, SO2 4 四面体 AB4 AB3 AB2 4 3 2 0 1 2 正四面体 三角锥形 V 形 SiF4, SO4 2- NH3, H3O + H2O, H2S 5 三角双锥 AB5 AB4 AB3 AB2 5 4 3 2 0 1 2 3 三角双锥形 变形四面体 T 形 直线形 PCl5, PF5 SF4, TeCl4 ClF3 I3 —, XeF2 6 八面体 AB6 AB5 AB4 6 5 4 0 1 2 正八面体 四方锥形 平面正方形 SF6, AlF6 3— BrF5 , SbF5 2— ICl4 —, XeF4

第四节分子轨道理论简介一、分子轨道理论的要点①分子轨道理论把分子作为一个整体考虑,分子中的电子不再从属于某个原子,而是在整个分子空间范围内运动。电子的运动状态用分子的波函数(称为分子轨道)来描述。②分子轨道的名称用6、元、8...符号表示。分子轨道可以由分子中原子轨道的线性组合(LCAO)而得到。几个原子轨道可组合成几个分子轨道:原子轨道线性相加组成的分子轨道称为成键分子轨道,其能量低于组合前原子轨道的能量;原子轨道线性相减组成的分子轨道称为反键分子轨道,能量高于组合前原子轨道的能量;非键分子轨道的能量等于组合前原子轨道的能量。③原子轨道线性组合成分子轨道必须符合对称性匹配原则、能量相近原则和最大重叠原则。圆柱形对称的原子轨道组成分子轨道:平面反对称的原子轨道组成元分子轨道。④电子在分子轨道中的排布也遵守Pauli不相容原理、能量最低原理和Hund规则。③在分子轨道理论中,用键级表示键的牢固程度。键级=一(成键轨道的电子数一反键轨道的电子数)2通常键级愈高,键能愈大,键愈稳定;键级为零,则原子不可能结合成分子。第二周期同核双原子分子的分子轨道能级图有两种类型(见教材),图10一13(a)适用于原子序数小的B、C、N、双原子分子,图10一13(b)适用于原子序数大的O2、F2等分子。根据不同的分子选择适当能级顺序,遵循电子排布规则可写出相应的分子轨道表示式。分子轨道中有单电子的分子具有顺磁性,无单电子的则具有反磁性。异核双原子分子的分子轨道能级图和分子轨道电子排布式不同于同核双原子分子,但同样遵循原子轨道线性组合成分子轨道的三条原则。第五节分子间的作用力分子间的作用力有vanderWaals力和氢键。vanderWaals力的产生与分子的极性和极化密切相关。分子的极化是指分子在外电场作用下发生的结构变化。vanderWaals力包括取向力、诱导力、色散力;其作用能只有几个到几十千焦每摩尔,约比化学键小1~2个数量级。大多数分子间的vanderWaals力以色散力为主,只有极性大的分子(如水分子)取
第四节 分子轨道理论简介 一、分子轨道理论的要点 ①分子轨道理论把分子作为一个整体考虑,分子中的电子不再从属于某个原 子,而是在整个分子空间范围内运动。电子的运动状态用分子的波函数 ψ(称为 分子轨道)来描述。②分子轨道的名称用 σ、π、δ.符号表示。分子轨道可以由 分子中原子轨道的线性组合(LCAO)而得到。几个原子轨道可组合成几个分子 轨道:原子轨道线性相加组成的分子轨道称为成键分子轨道,其能量低于组合前 原子轨道的能量;原子轨道线性相减组成的分子轨道称为反键分子轨道,能量高 于组合前原子轨道的能量;非键分子轨道的能量等于组合前原子轨道的能量。③ 原子轨道线性组合成分子轨道必须符合对称性匹配原则、能量相近原则和最大重 叠原则。圆柱形对称的原子轨道组成 σ 分子轨道;平面反对称的原子轨道组成 π 分子轨道。④电子在分子轨道中的排布也遵守 Pauli 不相容原理、能量最低原理 和 Hund 规则。⑤在分子轨道理论中,用键级表示键的牢固程度。 键级= 2 1 (成键轨道的电子数-反键轨道的电子数) 通常键级愈高,键能愈大,键愈稳定;键级为零,则原子不可能结合成分子。 第二周期同核双原子分子的分子轨道能级图有两种类型(见教材),图 10- 13(a)适用于原子序数小的 B、C 、N、双原子分子,图 10-13(b)适用于 原子序数大的 O2、F2 等分子。根据不同的分子选择适当能级顺序,遵循电子排 布规则可写出相应的分子轨道表示式。分子轨道中有单电子的分子具有顺磁性, 无单电子的则具有反磁性。 异核双原子分子的分子轨道能级图和分子轨道电子排布式不同于同核双原 子分子,但同样遵循原子轨道线性组合成分子轨道的三条原则。 第五节 分子间的作用力 分子间的作用力有 van der Waals 力和氢键。 van der Waals 力的产生与分子的极性和极化密切相关。分子的极化是指分 子在外电场作用下发生的结构变化。van der Waals 力包括取向力、诱导力、色散 力;其作用能只有几个到几十千焦每摩尔,约比化学键小 1~2 个数量级。大多 数分子间的 van der Waals 力以色散力为主,只有极性大的分子(如水分子)取

向力才比较显著,诱导力通常都很小。表10一03三种分子间作用力及其产生分子的极性分子间作用力的种类产生原因非极性分子之间色散力瞬时偶极非极性与极性分子之间色散力,诱导力瞬时偶极,诱导偶极瞬时偶极,诱导偶极,极性分子之间色散力,诱导力,取向力永久偶极当氢原子与电负性大,半径小的原子以共价键结合时,这种氢原子能与另一电负性大、半径小的有孤对电子的原子之间产生吸引作用,这种作用力称为氢键。氢键的键能一般在42kJ-mol-以下,它比化学键弱得多,但比vanderWaals力强。氢键具有饱和性和方向性。vanderWaals力及氢键的形成对物质的性质,如熔点、沸点、溶解度有一定影响。难题解析例10一1试用杂化轨道理论说明乙烯分子的形成及其构型。析根据杂化轨道理论,形成乙烯分子时,C原子的价层电子要杂化。共价键形成时,6键在成键两原子间能单独存在,且只存在一个;几键在成键两原子间不能单独存在,但可存在多个。乙烯分子中C原子的4个价电子分别与其它原子形成三个α键,C、C原子间的双键中有一个是几键。三个α键决定分子构型,因此C原子有三个原子轨道参与杂化,形成三个等性杂化轨道。解乙烯分子C2H4中有2个C原子和4个H原子,每个基态C原子的价层电子组态为2s22p2,在形成乙烯分子的过程中,1个2s电子被激发到2p空轨道上,然后1个2s轨道和2个2p轨道杂化形成3个等同的sp2杂化轨道,彼此间夹角为120%。每个C原子的2个sp?杂化轨道各与1个H原子的1s轨道重叠形成2个C一H键;2个C原子间各以1个sp2杂化轨道互相重叠,形成1个c键。由于2个C原子的这6个sp2杂化轨道处于同一平面,未参与杂化的2pz轨道则垂直于该平面,“肩并肩”重叠形成1个元键,构成C=C双键。乙烯分子中6个原子在一个平面上,分子呈平面构型。例10-2利用价层电子对互斥理论预测13°的空间构型。析先确定中心原子的价电子对数,中心原子提供7个电子,配位提供1个电子,加上负离子的电荷数,得价层电子数的总和再除以2。然后根据价层电子
向力才比较显著,诱导力通常都很小。 表 10-03 三种分子间作用力及其产生 分子的极性 分子间作用力的种类 产生原因 非极性分子之间 色散力 瞬时偶极 非极性与极性分子之间 色散力,诱导力 瞬时偶极,诱导偶极 极性分子之间 色散力,诱导力,取向力 瞬时偶极,诱导偶极, 永久偶极 当氢原子与电负性大,半径小的原子以共价键结合时,这种氢原子能与另一 电负性大、半径小的有孤对电子的原子之间产生吸引作用,这种作用力称为氢键。 氢键的键能一般在 42 kJ· mol-1 以下,它比化学键弱得多,但比 van der Waals 力强。氢键具有饱和性和方向性。 van der Waals 力及氢键的形成对物质的性质,如熔点、沸点、溶解度有一定 影响。 难题解析 例 10-1 试用杂化轨道理论说明乙烯分子的形成及其构型。 析 根据杂化轨道理论,形成乙烯分子时,C 原子的价层电子要杂化。共价 键形成时,σ 键在成键两原子间能单独存在,且只存在一个;л 键在成键两原子 间不能单独存在,但可存在多个。乙烯分子中 C 原子的 4 个价电子分别与其它 原子形成三个 σ 键,C、C 原子间的双键中有一个是 л 键。三个 σ 键决定分子构 型,因此 C 原子有三个原子轨道参与杂化,形成三个等性杂化轨道。 解 乙烯分子 C2H4 中有 2 个 C 原子和 4 个 H 原子,每个基态 C 原子的价层 电子组态为 2s2 2p2,在形成乙烯分子的过程中,1 个 2s 电子被激发到 2p 空轨道 上,然后 1 个 2s 轨道和 2 个 2p 轨道杂化形成 3 个等同的 sp2 杂化轨道,彼此间 夹角为 120º。每个 C 原子的 2 个 sp2 杂化轨道各与 1 个 H 原子的 1s 轨道重叠形 成 2 个 C—H σ 键;2 个 C 原子间各以 1 个 sp2 杂化轨道互相重叠,形成 1 个 σ 键。 由于 2 个 C 原子的这 6 个 sp2 杂化轨道处于同一平面,未参与杂化的 2pz 轨道则垂直于该平面, “肩并肩” 重叠形成 1 个 π 键,构成 C=C 双键。 乙烯分子中 6 个原子在一个平面上,分子呈平面构型。 例 10-2 利用价层电子对互斥理论预测 I3 - 的空间构型。 析 先确定中心原子的价电子对数,中心原子提供 7 个电子,配位提供 1 个 电子,加上负离子的电荷数,得价层电子数的总和再除以 2。然后根据价层电子

对构型和孤对电子决定I3°的空间构型。解I3中有3个1原子,我们可将其中1个I作为中心原子,其余2个作为配位体。中心原子1有7个价电子,2个配位1原子各提供1个电子,I3离子的负电荷数为1,所以中心原子的价电子对数为(7+2+1)2=5。价层电子对构型为三角双锥,因配位原子数为2,说明价层电子对中有2对成键电子对和3对孤对电子,以3对孤对电子处在三角双锥的三角形平面上排斥能最小,所以I3为直线型。例10-3画出NO的分子轨道,并用分子轨道法写出它的电子排布,并说明:①它的键级是多少?②它的键长应比NO-更长或更短?③有几个单电子?④并从键级推测NO+化合物存在的可能性。③讨论NO、NO-、NO+的磁性和稳定性。析异核双原子分子的原子序数和<14时,则符合分子轨道能级图10-13(b)的能级顺序;≥14时,则符合分子轨道能级图10-13(a)的能级顺序。写出NO+、NO、NO-分子轨道式,判断键级、键长、键能。根据是否存在单电子,判断磁性。解NO的分子轨道为/02px112p士12p/L1元2pIf02s它们的分子轨道式为:NNO0NO+[(α1s)(01s)2 (02s)(02s)2(02px)(元/2py)(元2pz)]NO[(α1s)(α1s ) (02s)(α2s)(@2px)(元2py)(元2pz)(元2py*)’]NO-[(α1s)(α1s*)2 (α2s)(α2s)(@2px)2 (元2py)P(元2pz)(元2py*)(元2pz*)"]
对构型和孤对电子决定 I3 - 的空间构型。 解 I3 -中有 3 个 I 原子,我们可将其中 1 个 I 作为中心原子,其余 2 个作为 配位体。中心原子 I 有 7 个价电子,2 个配位 I 原子各提供 1 个电子,I3 -离子的 负电荷数为 1,所以中心原子的价电子对数为(7 + 2 + 1)∕2 = 5 。价层电子对 构型为三角双锥,因配位原子数为 2,说明价层电子对中有 2 对成键电子对和 3 对孤对电子,以 3 对孤对电子处在三角双锥的三角形平面上排斥能最小,所以 I3 - 为直线型。 例 10-3 画出 NO 的分子轨道,并用分子轨道法写出它的电子排布,并说明: ①它的键级是多少?②它的键长应比 NO-更长或更短?③有几个单电子?④并 从键级推测 NO+化合物存在的可能性。⑤讨论 NO、NO-、NO+的磁性和稳定性。 析 异核双原子分子的原子序数和≤14 时,则符合分子轨道能级图 10-13(b) 的能级顺序;≥14 时,则符合分子轨道能级图 10-13(a)的能级顺序。写出 NO+、 NO、NO-分子轨道式,判断键级、键长、键能。根据是否存在单电子,判断磁 性。 解 NO 的分子轨道为 它们的分子轨道式为: NO+ [(σ1s) 2 (σ1s* ) 2 (σ2s) 2 (σ2s* ) 2 (σ2px) 2 (π2py) 2 (π2pz) 2 ] NO [(σ1s) 2 (σ1s * ) 2 (σ2s) 2 (σ2s * ) 2 (σ2px) 2 (π2py) 2 (π2pz) 2 (π2py*)1 ] NO- [(σ1s) 2 (σ1s * ) 2 (σ2s) 2 (σ2s * ) 2 (σ2px) 2 (π2py) 2 (π2pz) 2 (π2py*)1 (π2pz*)1 ] 2p 2s 2p σ2px* σ2px σ2s * σ2s π2p π2p* 2s N NO O

①NO 的键级=10=5=2.5;NO-的键级=10=2:NO+的键级=10-4=3。222②由于NO-的键级比NO的键级小,故NO-的键长比NO的键长长。③NO分子有一个单电子。④从键级3推测,NO+可能存在。③NO有1个单电子,顺磁性;NO有2个单电子,顺磁性:NO+没有单电子,反磁性。一般而言,键级愈大,键愈牢固,故它们的稳定性顺序为NO+>NO>NO例10-4下列说法是否正确?说明理由。(1)非极性分子中不含极性键。(2)直线型分子一定是非极性分子。(3)非金属单质的分子间只存在色散力。(4)对羟基苯甲醛的熔点比邻羟基苯甲醛的熔点高。解(1)说法不正确。有的分子含极性键,但空间构型完全对称,键的极性可以相互抵消,因而是非极性分子。(2)说法不正确。双原子分子都是直线型,同核双原子分子化学键无极性,分子非极性;异核双原子分子化学键有极性,分子极性。多原子直线型分子中,若相同原子所形成的空间构型对称、键的极性可以相互抵消,分子非极性。如CO2:O=C=O。而由不同原子所形成的及空间构型不对称,键的极性不能相互抵消,为极性分子。如H一C=N。(3)说法不正确。非金属单质分子通常是非极性分子,分子间的作用力通常为色散力。但臭氧(O3)分子的空间构型为V形,>0,为极性分子,故分子之间存在取向力、诱导力和色散力。(4)说法正确。对羟基苯甲醛存在着分子间氢键,而邻羟基苯甲醛存在着分子内氢键,对羟基苯甲醛分子间的作用力远大于邻羟基苯甲醛分子间的作用力,熔化对羟基苯甲醛时必须消耗额外的能量去破坏分子间氢键,故对羟基苯甲醛的熔点高于邻羟基苯甲醛的熔点。例10-5某一化合物的分子式为AB2,A属第六主族元素,B属第七主族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98。试回答下列问题:(1)已知AB2分子的键角为103.3,推测AB2分子的中心原子A成键时采取
①NO 的键级= 2.5 2 10 5 = - ;NO-的键级= 2 2 10 6 = - ;NO+的键级= 3 2 10 4 = - 。 ②由于 NO-的键级比 NO 的键级小,故 NO-的键长比 NO 的键长长。 ③NO 分子有一个单电子。 ④从键级 3 推测,NO+可能存在。 ⑤NO 有 1 个单电子,顺磁性;NO-有 2 个单电子,顺磁性;NO+没有单电 子,反磁性。一般而言,键级愈大,键愈牢固,故它们的稳定性顺序为 NO+ >NO > NO- 例 10-4 下列说法是否正确?说明理由。 (1) 非极性分子中不含极性键。 (2) 直线型分子一定是非极性分子。 (3) 非金属单质的分子间只存在色散力。 (4) 对羟基苯甲醛的熔点比邻羟基苯甲醛的熔点高。 解 (1) 说法不正确。有的分子含极性键,但空间构型完全对称,键的极性 可以相互抵消,因而是非极性分子。 (2) 说法不正确。双原子分子都是直线型,同核双原子分子化学键无极性, 分子非极性;异核双原子分子化学键有极性,分子极性。多原子直线型分子中, 若相同原子所形成的空间构型对称、键的极性可以相互抵消,分子非极性。如 CO2:O=C=O。而由不同原子所形成的及空间构型不对称,键的极性不能相互抵 消,为极性分子。如 H—C≡N。 (3) 说法不正确。非金属单质分子通常是非极性分子,分子间的作用力通常 为色散力。但臭氧(O3) 分子的空间构型为 V 形,μ> 0,为极性分子,故分子之 间存在取向力、诱导力和色散力。 (4) 说法正确。对羟基苯甲醛存在着分子间氢键,而邻羟基苯甲醛存在着分 子内氢键,对羟基苯甲醛分子间的作用力远大于邻羟基苯甲醛分子间的作用力, 熔化对羟基苯甲醛时必须消耗额外的能量去破坏分子间氢键,故对羟基苯甲醛的 熔点高于邻羟基苯甲醛的熔点。 例 10-5 某一化合物的分子式为 AB2,A 属第六主族元素,B 属第七主族元 素,A 和 B 在同一周期,它们的电负性值分别为 3.44 和 3.98 。试回答下列问题: (1) 已知 AB2 分子的键角为 103.3º,推测 AB2 分子的中心原子 A 成键时采取

的杂化类型及AB2分子的空间构型。(2)A-B键的极性如何?AB2分子的极性如何?(3)AB2分子间存在哪些作用力?(5)AB2与H2O相比,何者的熔点、沸点较高?解(1)根据A、B的电负性值,可判断A元素为O,B元素为F,该分子为OF2。根据键角103.3°,知道该分子中O原子以不等性sp3杂化轨道与F原子成键,两个单电子sp3杂化轨道各与1个F原子的单电子2px轨道重叠形成sp3-p的键,余下的2个sp3杂化轨道各被1对孤对电子占据,对成键电子对产生较大的排斥,致使键角压缩(<109°28"),故OF2分子的空间构型为V形。(2)0一F键为极性共价键。OF2分子中键的极性不能抵消,为极性分子。(3)OF2分子间存在取向力、诱导力及色散力,其中色散力是主要的。(4)OF2分子中无H原子,分子间不能形成氢键,而H2O分子间能形成氢键,故OF2的熔点、沸点比H2O的低。相关知识介绍酶超分子结构化学一软化学键超分子化学已成为化学、生命科学、材料科学和信息科学等领域研究的热点和纽带。超分子化学至少有两点启示:一是分子间弱相互作用力在一定条件下可转化为强结合能:二是分子组装成的超分子体系可具有完全不同于原组成成分的全新性能。在众多化学和生物超分子体系中,酶超分子是最理想的模型超分子。不同结构类型的酶聚集体在动力学特征和生物学功能上很不相同。随着酶结构复杂程度的提升,相应新的性能不断突现。酶超分子体系与单体酶比较,功能上有如下优越性:反应方向和速率的高调节效率;体系化特征(一个信号可多方向传递等);反馈调控机制;多样性功能;高层次的识别反应等。对酶超分子体系的这些神奇功能的解释,依赖于对“软化学键的认识。酶超分子系统所具有的独特有序结构和新的宏观特性正是以其组分分子间非共价键弱相互作用力一一软化学键为基础的。有别于分子和配合物,超分子是主体和客体在满足能量匹配、几何匹配等条件下非共价键力的作用。(1)弱相互作用力的类型一一主要指范德华力(包括静电力、诱导力、色散力)、氢键、堆砌作用力(包括元-元堆积、n-元堆积、阳离子-元作用和疏水作用力等)
的杂化类型及 AB2 分子的空间构型。 (2) A-B 键的极性如何?AB2 分子的极性如何? (3) AB2 分子间存在哪些作用力? (5) AB2 与 H2O 相比,何者的熔点、沸点较高? 解 (1) 根据 A、B 的电负性值,可判断 A 元素为 O,B 元素为 F,该分子 为 OF2 。根据键角 103.3º,知道该分子中 O 原子以不等性 sp3 杂化轨道与 F 原子 成键,两个单电子 sp3 杂化轨道各与 1 个 F 原子的单电子 2px 轨道重叠形成 sp3 -p 的 σ 键,余下的 2 个 sp3 杂化轨道各被 1 对孤对电子占据,对成键电子对产生较 大的排斥,致使键角压缩(<109º28’),故 OF2 分子的空间构型为“V”形。 (2) O—F 键为极性共价键。OF2 分子中键的极性不能抵消,为极性分子。 (3) OF2 分子间存在取向力、诱导力及色散力,其中色散力是主要的。 (4) OF2 分子中无 H 原子,分子间不能形成氢键,而 H2O 分子间能形成氢键, 故 OF2 的熔点、沸点比 H2O 的低。 相关知识介绍 酶超分子结构化学——软化学键 超分子化学已成为化学、生命科学、材料科学和信息科学等领域研究的热点 和纽带。超分子化学至少有两点启示:一是分子间弱相互作用力在一定条件下可 转化为强结合能;二是分子组装成的超分子体系可具有完全不同于原组成成分的 全新性能。在众多化学和生物超分子体系中,酶超分子是最理想的模型超分子。 不同结构类型的酶聚集体在动力学特征和生物学功能上很不相同。随着酶结 构复杂程度的提升,相应新的性能不断突现。酶超分子体系与单体酶比较,功能 上有如下优越性:反应方向和速率的高调节效率;体系化特征(一个信号可多方 向传递等);反馈调控机制;多样性功能;高层次的识别反应等。对酶超分子体 系的这些神奇功能的解释,依赖于对“软化学键”的认识。 酶超分子系统所具有的独特有序结构和新的宏观特性正是以其组分分子间 非共价键弱相互作用力——软化学键为基础的。有别于分子和配合物,超分子是 主体和客体在满足能量匹配、几何匹配等条件下非共价键力的作用。 (1)弱相互作用力的类型——主要指范德华力(包括静电力、诱导力、色散力)、 氢键、堆砌作用力(包括 π-π 堆积、n-π 堆积、阳离子-π 作用和疏水作用力等)

库仑力及电子交换力几种形式另外较重要的还有共振、磁相互作用力等。(2)软化学键一是主客体间各种弱相互作用力的总效应。从热力学来理解,能量的降低和摘的增加使酶超分子体系稳定。降低能量的因素主要有①静电作用;②氢键;③M-L配位键;④元-元堆砌作用;③色散作用;③疏水作用。增加体系熵的因素主要有①鳌合效应:②大环效应;③疏水空腔效应。对于特定的酶超分子体系而言,其中特别重要的是氢键和疏水作用。(3)软化学键的特征一亲和性超分子主客体间弱相互作用力可在一定条件下起加和与协调作用,形成有一定方向性和选择性的强作用力,成为超分子形成、分子识别和分子组装的主要作用力。弱相互作用关键在于体系中起聚集作用的分子间力多具有整体的选择性即亲合性。超分子体系分子间弱相互作用力具有强的选择性,主要表现为电子结构选择性、立体结构选择性和取向与最大重叠即轨道对称性选择。分子间弱相互作用力是形成超分子化合物的基础。酶超分子结构化学方法学,从简单分子的识别到复杂的生命超分子体系,千差万别、功能各不相同,但形成基础是相同的,这就是分子间作用力的协同和空间的互补。研究这些作用力的特征和本质非常重要,目前主要有三类方法:实验方法、理论方法和分子生物学方法。酶超分子结构化学的研究中分子识别和超分子自组装的认识不仅对酶学理论发展至关重要,对相关的方法学技术等领域也是极其重要的。《基础化学(第六版)》习题解答1(1)α键是指两个原子的原子轨道沿键轴方向以“头碰头”方式重叠所形成的共价键;而元键是指两个原子轨道垂直于键轴以“肩并肩”方式重叠所形成的共价健。(2)共价键是指成键的两个原子各提供一个电子组成共用电子对所形成的化学键:而配位键是指成键的一个原子单独提供共用电子对所形成的共价键。(3)等性杂化是指所形成的杂化轨道的能量完全相等的杂化;而不等性杂化是指所形成的杂化轨道的能量不完全相等的杂化。(4)成键轨道是指由正负符号相同的两个原子轨道叠加而成,其能量比原来的原子轨道低的分子轨道;而反键轨道是指由正负符号不同的两个原子轨道叠
库仑力及电子交换力几种形式,另外较重要的还有共振、磁相互作用力等。: (2)软化学键——是主客体间各种弱相互作用力的总效应。从热力学来理解, 能量的降低和熵的增加使酶超分子体系稳定。降低能量的因素主要有①静电作 用;②氢键; ③M-L 配位键; ④π-π 堆砌作用; ⑤色散作用;⑥疏水作用。 增加体系熵的因素主要有①螯合效应; ②大环效应; ③疏水空腔效应。对于特 定的酶超分子体系而言,其中特别重要的是氢键和疏水作用。 (3)软化学键的特征——亲和性超分子主客体间弱相互作用力可在一定条件 下起加和与协调作用,形成有一定方向性和选择性的强作用力,成为超分子形成、 分子识别和分子组装的主要作用力。弱相互作用关键在于体系中起聚集作用的分 子间力多具有整体的选择性即亲合性。 超分子体系分子间弱相互作用力具有强的选择性,主要表现为电子结构选择 性、立体结构选择性和取向与最大重叠即轨道对称性选择。分子间弱相互作用力 是形成超分子化合物的基础。 酶超分子结构化学方法学,从简单分子的识别到复杂的生命超分子体系, 千差万别、功能各不相同,但形成基础是相同的,这就是分子间作用力的协同和 空间的互补。研究这些作用力的特征和本质非常重要,目前主要有三类方法:实 验方法、理论方法和分子生物学方法。酶超分子结构化学的研究中分子识别和超 分子自组装的认识不仅对酶学理论发展至关重要,对相关的方法学技术等领域也 是极其重要的。 《基础化学(第六版)》习题解答 1. (1)σ 键是指两个原子的原子轨道沿键轴方向以“头碰头”方式重叠所形 成的共价键;而 π 键是指两个原子轨道垂直于键轴以“肩并肩”方式重叠所形成的 共价健。 (2)共价键是指成键的两个原子各提供一个电子组成共用电子对所形成的 化学键;而配位键是指成键的一个原子单独提供共用电子对所形成的共价键。 (3)等性杂化是指所形成的杂化轨道的能量完全相等的杂化;而不等性杂 化是指所形成的杂化轨道的能量不完全相等的杂化。 (4)成键轨道是指由正负符号相同的两个原子轨道叠加而成,其能量比原 来的原子轨道低的分子轨道;而反键轨道是指由正负符号不同的两个原子轨道叠

加而成,其能量比原来的原子轨道高的分子轨道。(5)永久偶极是指极性分子的正、负电荷的重心不重合,分子本身存在的偶极;瞬间偶极是指由于分子内部的电子在不断地运动和原子核在不断地振动,使分子的正、负电荷的重心不断发生瞬间位移而产生的偶极。(6)vanderWaals力是指分子之间存在的静电引力;而氢键是指氢原子与半径小,电负性大的原子以共价键结合的同时又与另一个半径小、电负性大的原子的孤对电子之间产生的静电吸引力。氢键的作用力比vanderWeaals力强。2.根据Pauli不相容原理,一个轨道中最多只能容纳两个自旋方式相反的电子。因此,一个原子中有几个单电子,就可以与几个自旋方式相反的单电子配对成键。即一个原子形成的共价键的数目取决于其本身含有的单电子数目。因此,共价键具有饱和性。共价键是由成键原子的价层原子轨道相互重叠形成的。根据最大重叠原理,原子轨道只有沿着某一特定方向才能形成稳定的共价键(s轨道与s轨道重叠除外),因此,共价键具有方向性。3.(1)P原子的外层电子组态为3s3p,有1对孤对电子和3个单电子。当P原子与H原子化合时,P原子采用sp不等性杂化,其中P原子的一对孤对电子占有一个sp3杂化轨道,另3个sp3杂化轨道分别与3个H原子的s轨道成键,故PH3分子的空间构型为三角锥形。(2)Hg原子的外层电子组态为6s2,当Hg原子与CI原子化合时,Hg原子的1个6s电子激发到6p轨道,进行sp杂化,2个sp杂化轨道分别与2个C1原子的3p轨道成键,故HgCl2分子的空间构型为直线。(3)Sn原子的外层电子组态为5s25p2,当Sn原子与Cl原子化合时,Sn原子的1个5s电子被激发到5p轨道,进行sp3等性杂化,4个sp3杂化轨道分别与4个CI原子的3p轨道成键,故SnCl4分子的空间构型为正四面体。(4)Se原子的外层电子组态为4s24p4,Se有2对孤对电子和2个单电子。当Se原子与Br原子化合时,Se原子采用sp3不等性杂化,其中Se原子的2对孤对电子占有2个sp杂化轨道,另2个sp杂化轨道分别与2个Br的4p轨道成键,故SeBr2分子的空间构型为V形。(5)0原子的外层电子组态为2s22p4,0有2对孤对电子和2个单电子
加而成,其能量比原来的原子轨道高的分子轨道。 (5)永久偶极是指极性分子的正、负电荷的重心不重合,分子本身存在的 偶极;瞬间偶极是指由于分子内部的电子在不断地运动和原子核在不断地振动, 使分子的正、负电荷的重心不断发生瞬间位移而产生的偶极。 (6)van der Waals 力是指分子之间存在的静电引力;而氢键是指氢原子与 半径小,电负性大的原子以共价键结合的同时又与另一个半径小、电负性大的原 子的孤对电子之间产生的静电吸引力。氢键的作用力比 van der Weaals 力强。 2. 根据 Pauli 不相容原理,一个轨道中最多只能容纳两个自旋方式相反的电 子。因此,一个原子中有几个单电子,就可以与几个自旋方式相反的单电子配对 成键。即一个原子形成的共价键的数目取决于其本身含有的单电子数目。因此, 共价键具有饱和性。 共价键是由成键原子的价层原子轨道相互重叠形成的。根据最大重叠原理, 原子轨道只有沿着某一特定方向才能形成稳定的共价键(s 轨道与 s 轨道重叠除 外),因此,共价键具有方向性。 3. (1)P 原子的外层电子组态为 3s23p3,有 1 对孤对电子和 3 个单电子。 当 P 原子与 H 原子化合时,P 原子采用 sp3 不等性杂化,其中 P 原子的一对孤对 电子占有一个 sp3 杂化轨道,另 3 个 sp3 杂化轨道分别与 3 个 H 原子的 s 轨道成 键,故 PH3 分子的空间构型为三角锥形。 (2)Hg 原子的外层电子组态为 6s2,当 Hg 原子与 Cl 原子化合时,Hg 原子 的 1 个 6s 电子激发到 6p 轨道,进行 sp 杂化,2 个 sp 杂化轨道分别与 2 个 Cl 原 子的 3p 轨道成键,故 HgCl2 分子的空间构型为直线。 (3)Sn 原子的外层电子组态为 5s25p2,当 Sn 原子与 Cl 原子化合时,Sn 原 子的 1 个 5s 电子被激发到 5p 轨道,进行 sp3 等性杂化,4 个 sp3 杂化轨道分别与 4 个 Cl 原子的 3p 轨道成键,故 SnCl4 分子的空间构型为正四面体。 (4)Se 原子的外层电子组态为 4s24p4,Se 有 2 对孤对电子和 2 个单电子。 当 Se 原子与 Br 原子化合时,Se 原子采用 sp3 不等性杂化,其中 Se 原子的 2 对 孤对电子占有 2 个 sp3 杂化轨道,另 2 个 sp3 杂化轨道分别与 2 个 Br 的 4p 轨道 成键,故 SeBr2 分子的空间构型为 V 形。 (5)O 原子的外层电子组态为 2s22p4,O 有 2 对孤对电子和 2 个单电子
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《医学有机化学》课程学习指导(医用基础化学)综合测试题(无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十二章 滴定分析(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十四章 现代仪器分析简介(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十三章 可见分光光度法和紫外分光光度法(含测试,无答案).doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-1-实验指导-基础部分.doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-1-实验指导-无机实验.doc
- 《医学有机化学》课程教学资源(实验指导)实验化学B-2-实验指导-有机化学实验(共十九个实验).doc
- 《医学有机化学》课程教学资源(授课教案)有机化学实验教案2010-2011学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)医学有机化学教案2010-2011学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)医用基础化学实验2011-2012学年第二学期.doc
- 《医学有机化学》课程教学资源(授课教案)医用基础化学教案2011-2012学年第一学期.doc
- 《医学有机化学实验》课程教学大纲 Organic chemistry.doc
- 《医用基础化学实验》课程教学大纲.doc
- 《医学有机化学》课程教学大纲 Medicinal Organic Chemistry.doc
- 《医用基础化学》课程教学大纲 Medic Basis Chemistry.doc
- 《实验化学》课程教学课件(PPT讲稿)粗食盐的提纯.ppt
- 《实验化学》课程教学课件(PPT讲稿)醋酸电离度和电离常数的测定.ppt
- 《实验化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《实验化学》课程教学课件(PPT讲稿)铵盐中氮含量的测定(甲醛法).ppt
- 《实验化学》课程教学课件(PPT讲稿)Na2CO3和NaHCO3混合碱含量的测定(双指示剂法).ppt
- 《医学有机化学》课程学习指导(医用基础化学)第八章 氧化还原反应与电极电位(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第十一章 配位化合物(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第九章 原子结构和元素周期律(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第五章 胶体溶液(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第七章 化学反应速率(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第四章 缓冲溶液(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第六章 化学反应热及化学反应的方向和限度(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第一章 绪论(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第三章 电解质溶液(含测试,无答案).doc
- 《医学有机化学》课程学习指导(医用基础化学)第二章 稀溶液的依数性(含测试,无答案).doc
- 《医学有机化学》课程学习指导(知识要点)第13章 脂类.pdf
- 《医学有机化学》课程学习指导(知识要点)第14章 氨基酸、蛋白质和核酸.pdf
- 《医学有机化学》课程学习指导(知识要点)第11章 芳香杂环化合物.pdf
- 《医学有机化学》课程学习指导(知识要点)第09章 立体异构.pdf
- 《医学有机化学》课程学习指导(知识要点)第10章 含氮有机化合物.pdf
- 《医学有机化学》课程学习指导(知识要点)第08章 羟基酸和酮酸.pdf
- 《医学有机化学》课程学习指导(知识要点)第12章 糖类.pdf
- 《医学有机化学》课程学习指导(知识要点)第04章 卤代烃.pdf
- 《医学有机化学》课程学习指导(知识要点)第05章 醇酚醚.pdf
- 《医学有机化学》课程学习指导(知识要点)第07章 羧酸及其衍生物.pdf
