西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 07 Acids and Bases

Section G/ Acids and Bases Bronsted acids and bases A Bronsted acid is a proton donor A Bronsted base is a proton acceptor Lewis acids and bases A Lewis acid is an electron acceptor A Lewis base is an electron donor
Section G Acids and Bases Bronsted acids and bases A Bronsted acid is a proton donor A Bronsted base is a proton acceptor Lewis acids and bases A Lewis acid is an electron acceptor A Lewis base is an electron donor

1、酸碱概念的发展 1663年(英)Boyle,R. 酸具有酸味,能使蓝色石蕊变红 碱具有苦涩味,能使红色石蕊变蓝 必18世纪后期,从物质内在性质认识酸碱 l781年(法)Lavoisier,A.L 酸是一类含氧化合物,氧一酸素 ◇19世纪初,HCL,HI等被发现 1811年DayD.P. 提出“氢是酸的基本元素"的论点
1、酸碱概念的发展 1663年 (英)Boyle, R. 酸具有酸味,能使蓝色石蕊变红 碱具有苦涩味,能使红色石蕊变蓝 18世纪后期,从物质内在性质认识酸碱 1781年 (法)Lavoisier, A. L. 酸是一类含氧化合物,氧——酸素 19世纪初,HCl,HI等被发现 1811年 Davy, D. P. 提出“氢是酸的基本元素”的论点

1、酸碱概念的发展 19世纪后期,近代酸碱理论开始形成 A、1889年Arrhenius,S.A.水-离子论 20世纪 B、Franklin,F.C.溶剂论 C、Bronsted,J.N.-Lowry,T.M.质子论 D、Lewis,G.N.电子论 E、Pearson,R.G.软硬酸碱理论
1、酸碱概念的发展 19世纪后期,近代酸碱理论开始形成 A、1889年 Arrhenius, S. A. 水-离子论 20世纪 B、 Franklin, F.C. 溶剂论 C、Bronsted, J. N.----Lowry, T. M. 质子论 D、Lewis, G. N. 电子论 E、Pearson, R. G. 软硬酸碱理论

酸碱概念的发展 ◆Arrihenius离子论 在水溶液中能电离出氢离子的物质称为 酸;能电离出氢氧根离子的物质称为碱 必局限性: 不能解释非水体系和非溶剂体系的问题 1)》 C,H,ONa溶于乙醇 2) 2 Na 2 NH3 2 Na 2NH2 H2 3 NH3(g)+HCI(g) NHACI
酸碱概念的发展 Arrihenius 离子论 在水溶液中能电离出氢离子的物质称为 酸;能电离出氢氧根离子的物质称为碱 局限性: 不能解释非水体系和非溶剂体系的问题 ( 1 ) C 2 H 5 O- N a + 溶于乙醇 ( 2 ) 2 Na + 2 NH 3 2 Na + + 2N H 2 - + H 2 ( 3 ) NH 3(g) + H C l (g) N H 4 +Cl-

Acids and Bases:General Principles Bronsted-Lowry definition an acid is a proton donor a base is a proton acceptor
Acids and Bases: General Principles Acids and Bases: General Principles Br ønsted-Lowry definition an acid is a proton donor a base is a proton acceptor

Bronsted,J.N.--Lowry,T.M.质千论 十十 ,凡能给出质子的分子或离子都是酸 B.凡能与质子结合的分子或离子都是碱 C.酸碱反应是两个共轭酸碱对之间质子传递反应 H2PO4- H++ HPO2- NH4 H+NH3 CHCOOH H++ CHCOO 共轭酸 共轭碱
2、Bronsted, J. N.---Lowry, T. M. 质子论 A. 凡能给出质子的分子或离子都是酸 B. 凡能与质子结合的分子或离子都是碱 C. 酸碱反应是两个共轭酸碱对之间质子传递反应 H2PO4- H+ + HPO42- NH4+ H+ + NH3 CH3COOH H+ + CH3COO- 共轭酸 共轭碱

十十于 Bronsted,J.N.--Lowry,T.M.质子论 质子酸碱理论 质子论离开溶剂而从物质能否授受质子给酸碱下定 义,有机化合物中含有大量的C-H,O-H,N-H, S-H,PH键,因此,可以从质子酸碱的强弱来判 断它们的反应情况。 质子酸碱的强弱可以用pKa的大小比较判断 pKa值越大,则酸性越弱 pKa值越小,则酸性越强
2、Bronsted, J. N.---Lowry, T. M. 质子论 质子酸碱理论 ¾ 质子论离开溶剂而从物质能否授受质子给酸碱下定 义,有机化合物中含有大量的C-H,O-H,N-H, S-H,P-H键,因此,可以从质子酸碱的强弱来判 断它们的反应情况。 ¾ 质子酸碱的强弱可以用pKa的大小比较判断 pKa值越大,则酸性越弱 pKa值越小,则酸性越强
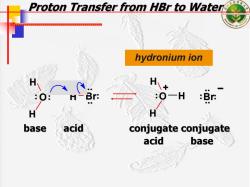
Proton Transfer from HBr to Water 十十 hydronium ion :Br base acid conjugate conjugate acid base
Proton Transfer from Proton Transfer from HBr to Water to Water hydronium ion O H Br H H . . . . H H . .O H Br – . . . . .. .. .. .. . . + base acid conjugate conjugate conjugate conjugate acid base
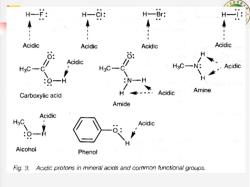
H-: H-CI: HBr: H一 Acidic Acidic Acidic Acidic 6 Acidic HgC H3C-C" H3C-N: Acidic :O-H :N-H Carboxylic acid H Acidic Amine Amide Acidic Acidic Alcohol Phenol Fig.3.Acidic protons in mineral acids and common functional groups
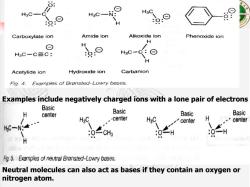
8: H3C- H3C- H Carboxylate ion Amide ion Alkoxide ion Phenoxide ion H ⊙ H HsC-C三C: H3C- Acetylide ion Hydroxide ion Carbanion Fig.4.Examples of Bronsted-Lowry bases. Examples include negatively charged ions with a lone pair of electrons Basic H Basic center Basic Basic HgC -center center H center C一Ng 0H H Fg.5.Examples of neutral Bronsted-Lowry bases. Neutral molecules can also act as bases if they contain an oxygen or nitrogen atom
Neutral molecules can also act as bases if they contain an oxygen or nitrogen atom. Examples include negatively charged ions with a lone pair of electrons
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 06 reactions and mechanisms.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 05 Nucleophiles and Electrophiles.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 04 stereochemistry.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 03 functional groups.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 02 Alkanes and cycloalkane.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 01 Structure And Bonding(主讲:王俊儒).pdf
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Infrared Spectroscopy and Mass Spectrometry.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Substitution and Elimination.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Reactions of Alcohols.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Proton NMR Spectroscopy.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Organic Reactions.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Nomenclature of Saturated Hydrocarbons.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Mass Spectrometry.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Ketones and Aldehydes.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Infrared(IR)spectroscopy.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Functional Groups.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Ethers.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Enols and Enolates.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Conjugated Dienes and U.V. Spectroscopy.ppt
- 《有机化学》课程PPT教学课件(Organic Chemistry, William A. Price, Ph.D. PPT, La Salle University, L.G.WADE, JR., 8th Edition)Conformational Analysis.ppt
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 08 Alkenes and Alkynes.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 09 Aromatic chemistry.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 10 Aldehydes and ketones.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2009)Chapter 11 Carboxylic acids and carboxylic acid derivatives.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2010)Chapter 01 Introduction(主讲:王俊儒).pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2010)Chapter 02 Structure and Properties of OM.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2010)Chapter 03 Brief Introduction and Nomenclature of OC.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2010)Chapter 04 Structure and Stereochemistry of Alkanes(打印版).pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2010)Chapter 05 The Study of Chemical Reactions(打印版).pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2010)Chapter 06 Stereochemistry(打印版).pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2010)Chapter 07 Alkyl Halides Nucleophilic Substitution and Elimination(打印版).pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2012)Chapter 04 Structure and Stereochemistry of Alkanes.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2012)Chapter 17 & 18 Aromatic chemistry.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2012)Chapter 05 The Study of Chemical Reactions.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2012)Chapter 06 Stereochemistry.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2012)Chapter 07 Alkyl Halides Nucleophilic Substitution and Elimination.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2012)Chapter 08 & 09 Alkenes.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2012)Chapter 19 Ketones and Aldehydes.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2012)Chapter 20 Amines.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2012)Chapter 21 Carboxylic Acids.pdf
