武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第四节 外界因素对化学平衡的影响

外界因素对化学平衡的影响
外界因素对化学平衡的影响

第四节 外界因素对化学平衡的影响 ·本节主要讨论温度,压力和惰性气体对化学平衡的影响。 一.温度对化学平衡的影响: 。 若将反应平衡常数一般地记为K,有: △.Gm/T=-RlnK0 。 在恒压下对上式微分: [(A,Gm/T)/OT]p=-RdlnK/dT 由吉布斯-赫姆霍兹公式,有: ● [a(△Gm/T)/aT].=-△Hm/T2=-RdlnK/dT [dlnK/dT]。=△HmRT2 (1) ·△Hm>0,吸热反应 dlnK/dT>0升温对正向反应有利; ·△Hm0<0,放热反应 dlnK/dT<0【 降温对正向反应有利; △Hm0=0,无热反应 dlnK/dT=0温度对平衡无影响
第四节 外界因素对化学平衡的影响 • 本节主要讨论温度,压力和惰性气体对化学平衡的影响. • 一. 温度对化学平衡的影响: • 若将反应平衡常数一般地记为K0 ,有: • rGm/T=-RlnK0 • 在恒压下对上式微分: • [(rGm/T)/T]p =-RdlnK0 /dT • 由吉布斯-赫姆霍兹公式,有: • [(rGm 0 /T)/T]p =- rHm 0 /T2=-RdlnK0 /dT • [dlnK0 /dT]p =rHm 0 /RT2 (1) • rHm 0>0,吸热反应 dlnK0 /dT>0 升温对正向反应有利; • rHm 0<0,放热反应 dlnK0 /dT<0 降温对正向反应有利; • rHm 0=0,无热反应 dlnK0 /dT=0 温度对平衡无影响

。 通过()式,可以由某一温度下的反应平衡常数求算其它温度条 件的反应平衡常数. ·(1)△Hm0可以视为常数: 。 当反应体系的温度变化范围不大,或反应的△,C,0时,反应的 △H0可视为常数,对()式积分: In(K2/K=A,Hm/R[(T2-T/TT2] (2) lnK0=-△Hm0/RT+I (3) ·其中(2)式为定积分式;3)式为不定积分式,是积分常数. ·将nK对1/T作图可得一直线,直线的斜率等于-△HmR,用此 法可以通过测定不同温度下的反应平衡常数而求得反应的焓 变
• 通过(1)式,可以由某一温度下的反应平衡常数求算其它温度条 件的反应平衡常数. • (1) rHm 0可以视为常数: • 当反应体系的温度变化范围不大,或反应的rCp≈0时,反应的 rHm 0可视为常数,对(1)式积分: • ln(K0 2 /K0 1 )=rHm 0 /R·[(T2 -T1 )/T1T2 ] (2) • lnK0=-rHm 0 /RT + I (3) • 其中(2)式为定积分式;(3)式为不定积分式,I是积分常数. • 将lnK对1/T作图可得一直线,直线的斜率等于﹣rHm 0 /R,用此 法可以通过测定不同温度下的反应平衡常数而求得反应的焓 变

·例:反应(CH)2CHOH(g)=(CH)2CO(g+H2(g 在457.4K 时的K,=0.3600,△Hm(298.15K)=61500J.mo,若反应的△C, 近似为零.(1)求平衡常数的函数表达式;(2)求500K时反应的 平衡常数K,? ·解:() △,Cp0 △Hm=常数 lnKp=-△Hm/RT+I 代入题给457.4K的数值: =ln0.36+61500/(8.314457.4)=15.151 反应平衡常数的函数表达式为: lnK,0=-7379/T+15.151 (2)T=500K时,反应的平衡常数为: lnK,(500K=-7379/500+15.151=0.357 K,0=1.429 500K时此反应的平衡常数为1.429
• 例: 反应 (CH3 )2CHOH(g)=(CH3 )2CO(g)+H2 (g) 在457.4K 时的Kp 0=0.3600, rHm 0 (298.15K)=61500 J.mol-1 , 若反应的rCp 近似为零. (1) 求平衡常数的函数表达式; (2) 求500K时反应的 平衡常数Kp 0? • 解: (1) ∵ rCp=0 ∴ rHm 0=常数 • lnKp 0=﹣ rHm 0 /RT + I • 代入题给457.4K的数值: • I=ln0.36+61500/(8.314·457.4)=15.151 • 反应平衡常数的函数表达式为: • lnKp 0=﹣7379/T+15.151 • (2) T=500K时,反应的平衡常数为: • lnKp 0 (500K)=﹣7379/500+15.151=0.357 • Kp 0=1.429 • 500K时此反应的平衡常数为1.429

。(2)△Hm0随温度而变化: 当反应体系的温度变化范围很大,反应的△C0时,反应的焓变 不再为常数,是温度的函数.此时应先由基尔霍夫定律求出焓 变对温度的关系式,然后将其代入(2)式或(3)式中求算 一般物质的热容表达式为: Cp.m-a+bT+cT2 由基尔霍夫定律,可得反应焓变的数学表达式: △Hm0=△H+△aT+1/2△bT2+1/3△cT3 (4) 。 式中:△H时积分常数 ·将(4)式代入平衡常数的不定积分式中积分,可得: JdInK=△Hm/RT2dT =(△HRT2+△a/RT+△b/2R+△cT3R)dT lnK0=-△H/RT+△a/RlnT+△b/2RT+△cT26R+I(5) (⑤)式中△H,均为积分常数
• (2) rHm 0随温度而变化: • 当反应体系的温度变化范围很大,反应的rCp≠0时, 反应的焓变 不再为常数, 是温度的函数. 此时应先由基尔霍夫定律求出焓 变对温度的关系式,然后将其代入(2)式或(3)式中求算. • 一般物质的热容表达式为: • Cp,m=a+bT+cT2 • 由基尔霍夫定律,可得反应焓变的数学表达式: • rHm 0=H0+aT+1/2bT2+1/3cT3 (4) • 式中: H0时积分常数. • 将(4)式代入平衡常数的不定积分式中积分,可得: • ∫dlnK0=∫rHm 0 /RT2dT • =∫(H0 /RT2+a/RT+b/2R+cT/3R)dT • lnK0=-H0 /RT+a/R·lnT+b/2RT+cT2 /6R+I (5) • (5)式中H0 ,I均为积分常数
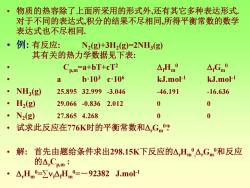
·物质的热容除了上面所采用的形式外,还有其它多种表达形式。 对于不同的表达式,积分的结果不尽相同,所得平衡常数的数学 表达式也不尽相同 ·例:有反应: N2(g)+3H2(g)=2NH3(g) 其有关的热力学数据见下表: Cp.m-a+bT+cT2 △Hm0 △rGm0 a b·103c106 kJ.mol-1 kJ.mol-1 ● NH(g) 25.89532.999-3.046 -46.191 -16.636 H2(g) 29.066-0.8362.012 0 0 N2(g) 27.8654.268 0 0 试求此反应在776K时的平衡常数和△,Gm? ·解: 首先由题给条件求出298.15K下反应的△Hm,△Gm和反应 的A,CBm: ·△Hm0-vAHm0=-92382J.mo1
• 物质的热容除了上面所采用的形式外,还有其它多种表达形式. 对于不同的表达式,积分的结果不尽相同,所得平衡常数的数学 表达式也不尽相同. • 例: 有反应: N2 (g)+3H2 (g)=2NH3 (g) 其有关的热力学数据见下表: • Cp,m=a+bT+cT2 fHm 0 fGm 0 • a b·103 c·106 kJ.mol-1 kJ.mol-1 • NH3 (g) 25.895 32.999 -3.046 -46.191 -16.636 • H2 (g) 29.066 -0.836 2.012 0 0 • N2 (g) 27.865 4.268 0 0 • 试求此反应在776K时的平衡常数和rGm 0? • 解: 首先由题给条件求出298.15K下反应的rHm 0 , rGm 0和反应 的rCp,m : • rHm 0=∑ifHm 0=-92382 J.mol-1

·△Gm(298.15K)=ViAGm0=-33272 J.mol-1 △rCpm0=y,Cpm=△a+AbT+△cTP △a=2:25.895-27.865-329.066=-63.273 △b=(232.999-4.268+30.836)103=64.23810-3 △c=(-23.064-32.012)10-6=-12.128:10-6 由298.15K的反应焓变求积分常数△H: △H=△Hm0-△aT-△bT2/2-△cT33=-76270J.mol 由△Gm(298.15K)求积分常数 =lnK,+△H/RT-△a/RlnT-△bT/2R-△cT26R =24.87 得K,对温度T的函数表达式: lnK,=9174/T-7.610lnT+3.863103T-2.43110-7T2+24.87 求776K下的值: lnK,0=-11.09 K,0=1.519×105 △,Gm(776K)=71580J.mo
• rGm 0 (298.15K)=∑ifGm 0=-33272 J.mol-1 • rCp,m 0=∑iCp,m =a+bT+cT2 • a=2·25.895-27.865-3·29.066=-63.273 • b=(2·32.999-4.268+3·0.836)·10-3=64.238·10-3 • c=(-2·3.064-3·2.012)·10-6=-12.128·10-6 • 由298.15K的反应焓变求积分常数H0 : • H0=rHm 0 - aT- bT2 /2-cT3 /3=-76270 J.mol-1 • 由rGm 0 (298.15K)求积分常数I: • I=lnKp 0+ H0 /RT - a/R·lnT- bT/2R-cT2 /6R • =24.87 • 得Kp 0对温度T的函数表达式: • lnKp 0=9174/T-7.610lnT+3.863·10-3T-2.431·10-7T2+24.87 • 求776K下的值: • lnKp 0=-11.09 Kp 0=1.519×10-5 • rGm 0 (776K)=71580 J.mol-1

·二.压力对化学平衡的影响: ·这儿所指的压力为体系的总压力 ·(1)压力对理想气体体系反应的影响: 。 理想气体的反应平衡常数K,取决于反应的△,Gm,△Gm是各组 分标态化学势的代数和.理想气体标态化学势的值与体系的压 力无关,所以理想气体平衡常数也与体系的压力无关,只是温度 T的函数. 。 当反应体系的温度一定时,反应平衡常数K,是一常数 ·但是,反应体系的平衡常数与平衡时的组成并不是一回事.平衡 常数变了,平衡时的组成必定改变;但体系平衡组成改变了,平衡 常数却不一定改变 ·反应的平衡组成实际上取决于K、,当K变化时,反应体系的平衡 组成也会发生变化. Kp0-K(p/p)Zvi =K(RT/p0)Evi
• 二. 压力对化学平衡的影响: • 这儿所指的压力为体系的总压力. • (1)压力对理想气体体系反应的影响: • 理想气体的反应平衡常数Kp 0取决于反应的rGm 0 ,rGm 0是各组 分标态化学势的代数和.理想气体标态化学势的值与体系的压 力无关,所以理想气体平衡常数也与体系的压力无关,只是温度 T的函数. • 当反应体系的温度一定时,反应平衡常数Kp 0是一常数. • 但是,反应体系的平衡常数与平衡时的组成并不是一回事.平衡 常数变了,平衡时的组成必定改变;但体系平衡组成改变了,平衡 常数却不一定改变. • 反应的平衡组成实际上取决于Kx ,当Kx变化时,反应体系的平衡 组成也会发生变化. • Kp 0=Kx (p/p0 ) ∑i • =Kc (RT/p0 ) ∑i

(oInKp/p)=0 。 (olnK /op)T+v;(oln(p/p)/op)=0 (olnK/Op)n=-v/p=-△,Vm/RT (6) 对(6)式进行分析,可知: 当反应温度恒定时,虽然K,为常数,但有: Evp0 降低压力对正向反应有利; Evi<O 增加压力对正向反应有利; v-0 改变压力对平衡无影响. 若反应分子数增加,降压对平衡正向移动有利; ·若反应分子数减少,增压对平衡正向移动有利: ·若反应分子数相等,压力对平衡的移动无影响
• ∵ (lnKp 0 /p)T=0 • ∴ (lnKx /p)T+∑i (ln(p/p0 )/p)T=0 • (lnKx /p)T=-∑i /p=-rVm/RT (6) • 对(6)式进行分析,可知: • 当反应温度恒定时,虽然Kp 0为常数,但有: • ∑i>0 降低压力对正向反应有利; • ∑i<0 增加压力对正向反应有利; • ∑i=0 改变压力对平衡无影响. • 若反应分子数增加,降压对平衡正向移动有利; • 若反应分子数减少,增压对平衡正向移动有利; • 若反应分子数相等,压力对平衡的移动无影响

·例:在601K,1p下,N204有50.2%离解,当体系的压力增加至10p 时,NO4的离解率为多少? 。解:反应为: N204 2N02 t=0: 1.0 0 。 平衡: 1-x 2x n=1+x Pi (1-x)/1+x)p 2x/(1+x)p 压力的单位取为p°,反应平衡常数为: ● K,=Kp=2x/(1+xp]2I1-x/1+xp =4x21(1-x2)p 当p=1p时,x=0.502,故: K=4×0.5022/(1-0.5022)1p=1.35p 反应温度不变时,平衡常数的值不变,设10p下的离解率为x: 4x2/(1-x2)10p0=1.35p0 解得: x=0.18
• 例: 在601K,1p0下,N2O4有50.2%离解,当体系的压力增加至10p0 时,N2O4的离解率为多少? • 解: 反应为: • N2O4 = 2NO2 • t=0: 1.0 0 • 平衡: 1-x 2x n=1+x • pi : (1-x)/(1+x)·p 2x/(1+x)·p • 压力的单位取为p 0 ,反应平衡常数为: • Kp 0=Kp=[2x/(1+x)·p]2 /[(1-x)/(1+x)·p] • =4x2 /(1-x 2 )·p • 当p=1p0时,x=0.502,故: • Kp=4×0.5022 /(1-0.5022 )·1p0=1.35 p0 • 反应温度不变时,平衡常数的值不变,设10p0下的离解率为x: • 4x2 /(1-x 2 )·10p0=1.35p0 • 解得: x=0.18
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第三节 平衡常数的求算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第一节 化学反应的方向和限度 第二节 化学反应平衡常数.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.6)三组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.3)双液系相图 liqiud-liqiud phase diagram.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.2)单组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.1)相律(phase law).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.9-3.11 渗透系数、超额函数(excess function)、分配定律.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.7-3.8 吉布斯-杜亥姆方程(Gibbs-Duhem Function)、非理想溶液.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.5-3.6 理想稀溶液 ideal dilute solution、稀溶液的依数性.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.4 理想溶液(ideal solutiom).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.1-3.3 溶液表示法、理想气体、实际气体、逸度.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.12)非平衡态热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.10-2.11)热力学第三定律、热力学函数的规定值.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.9)多组分体系热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.8)△G的计算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.6-2.7)赫氏自由能和吉氏自由能、热力学基本关系式.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(习题辅导).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.8)热化学 thermochemistry.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第五节 实例分析.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(热力学的统计基础).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(系综理论、配分函数、理想气体统计理论).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(量子统计法、Boltzmann分布律).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(分子配分函数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(物质的热容理论、理想气体化学势).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(化学反应平衡常数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学动力学的任务和目的).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应速率).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应的速率方程、积分速率方程-具有简单级数的反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(温度对反应速率的影响).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(几种典型的复杂反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(链反应及复杂反应动力学近似处理).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(传递现象 Transport Phenomenon).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(1/6)碰撞理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(2/6)碰撞理论在溶液反应中的应用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(3/6)过渡态理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(4/6)原盐效应.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(5/6)单分子反应理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(6/6)分子反应动态学(molecular reaction dynamics).ppt
