武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.6-2.7)赫氏自由能和吉氏自由能、热力学基本关系式

赫氏自由能 吉氏自由能 热力学基本关系式
赫氏自由能 吉氏自由能 热力学基本关系式

第六节赫氏自由能和吉氏自由能 ·熵判据从原理上虽然可以解决一) 自然过程的方向和限度问题,但使 用起来殊不方便,为了热力学判据 使用的方便,人们由熵函数发展出 赫氏自由能和吉氏自由能, 赫氏自由能用于等温等容过程。 ·吉氏自由能用于等温等压过程
第六节 赫氏自由能和吉氏自由能 • 熵判据从原理上虽然可以解决一切 自然过程的方向和限度问题, 但使 用起来殊不方便, 为了热力学判据 使用的方便, 人们由熵函数发展出 赫氏自由能和吉氏自由能. • 赫氏自由能用于等温等容过程. • 吉氏自由能用于等温等压过程
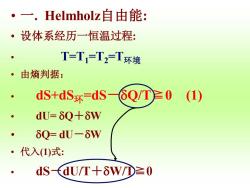
·一.Helmholz自由能: ·设体系经历一恒温过程: T=T=T2=T环境 ·由熵判据: ● dS+dS环=dS-6Q/T≥0 (1) ● dU=δQ+δW ● δQ=dU-δW ·代入(1)式: dS(dU/T+δW①≥0
• 一. Helmholz自由能: • 设体系经历一恒温过程: • T=T1=T2=T环境 • 由熵判据: • dS+dS环=dS-Q/T≧0 (1) • dU= Q+W • Q= dU-W • 代入(1)式: • dS-dU/T+W/T≧0

·两边同乘以T: ● TdS-dU+δW≥0 等温过程: TdS=d(TS) ● dTS)-dU≥-δW ● 一d(U一TS)≥一δW 令: F≡U一TS (2) ·F:赫氏自由能(Helmholz free energy) ·由德国科学家赫姆霍兹首先定义
• 两边同乘以T: • TdS-dU+W≧0 • 等温过程: • TdS=d(TS) • d(TS)-dU ≧ -W • -d(U-TS) ≧ -W • 令: F≡U-TS (2) • F :赫氏自由能(Helmholz free energy) • 由德国科学家赫姆霍兹首先定义

·将F代入熵判据式: 一dF≥一δW (3) ·或一△F≥一W 恒温过程 (4) (④F)I,y≤W:等温,等容,W体=O (5) ·对于等温,等容且无有用功的过程: △F≤0 (dT=0,dV=0,W=0) (6) 。 (⑥)式也为热力学判别式,其物理含义为: 在等温,等容,不作有用功的条件下,体 系的赫氏自由能只会自发地减少
• 将F代入熵判据式: • -dF≧ - W (3) • 或 -F≧ -W 恒温过程 (4) • (F)T,V≦Wf 等温,等容,W体=0 (5) • 对于等温,等容且无有用功的过程: • F≦0 (dT=0, dV=0, Wf=0) (6) • (6)式也为热力学判别式,其物理含义为: • 在等温,等容,不作有用功的条件下, 体 系的赫氏自由能只会自发地减少

·二.Gibbs自由能(Gibbs free energy) 。〉 对于恒温恒压过程: dS-8Q/T≥0 (熵判据) dU=δO+δW δQ=dU+pdV-δWt dS-dU/T-pdV/T+WT≥0 ● TdS-dU-pdV≥-oWr 两边同乘以T d(TS)-dU-dpV)≥-δWf.dT=0dp=0 ● -d(U+pV-TS)≥-δWt ● 令:G=H一TS (8) ≡F+pV (9) G称为吉布斯自由能
• 二. Gibbs自由能(Gibbs free energy) • 对于恒温恒压过程: • dS-Q/T≧0 (熵判据) • dU= Q+W Q= dU+pdV-Wf • dS-dU/T-pdV/T+Wf /T≧0 • TdS-dU-pdV≧-Wf 两边同乘以T • d(TS)-dU-d(pV) ≧-Wf ∵dT=0 dp=0 • -d(U+pV-TS) ≧- Wf • 令: G≡H-TS (8) • ≡F + pV (9) • G 称为吉布斯自由能

。将G代入嫡判据不等式: dG≤δWt (10) ·上式的物理含义是: 在恒温恒压下,体系吉布斯自由能的减少等 于体系可能作的最大有用功. 。】 若W=0,有: dG≤0 (dT=0,dp=0,W=O) (11) △G≤0 (dT=0,dp=0,W=0) (12) (11)和(12)均为自由能判据关系式.在恒温,恒压和 不作有用功的条件下,若dG<0,则是不可逆过程, dG=0为可逆过程
• 将G代入熵判据不等式: • dG≦Wf (10) • 上式的物理含义是: • 在恒温恒压下, 体系吉布斯自由能的减少等 于体系可能作的最大有用功. • 若Wf =0, 有: • dG≦0 (dT=0, dp=0, Wf =0) (11) • G≦0 (dT=0, dp=0, Wf =0) (12) • (11)和(12)均为自由能判据关系式. 在恒温,恒压和 不作有用功的条件下, 若dG<0, 则是不可逆过程, dG=0为可逆过程

吉布斯自由能在化学领域中具有极其广泛的 应用,一般化学反应均在恒温恒压下进行,因 而只要求算某化学反应的吉布斯自由能的变 化,即可由其数值的符号来判断反应的方向和 限度对于恒温恒压的可逆过程: △G=Wt (dT=0,dp=0) ·对于电化学反应过程,可由△G求出电池电动势: △G=一nFE (13)
• 吉布斯自由能在化学领域中具有极其广泛的 应用, 一般化学反应均在恒温恒压下进行, 因 而只要求算某化学反应的吉布斯自由能的变 化, 即可由其数值的符号来判断反应的方向和 限度.对于恒温恒压的可逆过程: • G =Wf (dT=0, dp=0) • 对于电化学反应过程, 可由G求出电池电动势: • G=-nFE (13)

三 热力学判据: U,H,S,F,G均为状态函数,其中S,F和G常用作 热力学判据: 。 1.熵判据: (△S)孤≥0 >0:为自发过程 =0: 可逆过程 <0:不可能过程 熵判据是所学的第一个热力学判据,也是最 重要的一个,其它判据均由熵判据导出.原则 上,熵判据可以判断一切过程的方向和限度
三. 热力学判据: • U,H,S,F,G均为状态函数, 其中S,F和G常用作 热力学判据. • 1. 熵判据: • (S)孤≧0 >0: 为自发过程 • =0: 可逆过程 • <0: 不可能过程 • 熵判据是所学的第一个热力学判据, 也是最 重要的一个, 其它判据均由熵判据导出. 原则 上, 熵判据可以判断一切过程的方向和限度

。2.赫氏自由能判据: ·(FD)m,v0 (dT=0,dV=0) 不自发不可逆过程 >WiR (dT-0,dV-0) 不可能过程 F主要用于等温、等容、且不作有用功的过 程方向的判断。 ·F函数判据在应用时,只需考虑体系,而不 必考虑环境
• 2. 赫氏自由能判据: • (F)T,V0 (dT=0, dV=0) 不自发不可逆过程 • >Wf,R (dT=0, dV=0) 不可能过程 • F主要用于等温、等容、且不作有用功的过 程方向的判断。 • F函数判据在应用时,只需考虑体系,而不 必考虑环境
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(习题辅导).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.8)热化学 thermochemistry.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.7)实际气体、节流过程.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.1-1.6).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)物理化学绪论.ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(1/2,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(1/2,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(9/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(7/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(6/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(5/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(4/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(3/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(2/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(1/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(12/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(11/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(08/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(07/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(05/17,图片版).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.8)△G的计算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.9)多组分体系热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.10-2.11)热力学第三定律、热力学函数的规定值.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.12)非平衡态热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.1-3.3 溶液表示法、理想气体、实际气体、逸度.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.4 理想溶液(ideal solutiom).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.5-3.6 理想稀溶液 ideal dilute solution、稀溶液的依数性.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.7-3.8 吉布斯-杜亥姆方程(Gibbs-Duhem Function)、非理想溶液.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.9-3.11 渗透系数、超额函数(excess function)、分配定律.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.1)相律(phase law).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.2)单组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.3)双液系相图 liqiud-liqiud phase diagram.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.6)三组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第一节 化学反应的方向和限度 第二节 化学反应平衡常数.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第三节 平衡常数的求算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第四节 外界因素对化学平衡的影响.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第五节 实例分析.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(热力学的统计基础).ppt
