吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(2/13,图片版)

026 §8.4离子迁移数(电输数) 按照离子独立移动定律,A=入+ A可测,但和2“不可测,因为正负离子 总是在一个体系中。 现在我们讨论正负离子的电输送问题。 (一)离子迁移现象 +++++ +++++ +++++ 例如上图所示,用+一分别代表正负离子的摩尔 电荷量,开始前三个区域的电荷量相同,每区5摩 尔电荷,通电后⊕→,←⊙进行移动

)当u=u.,通入4F电量时,在阴极上有4摩尔 电荷的正离子被还原,在阳极上有4摩尔电荷的负 离子被氧化。 正负离子输送的电量相同,各为2F,即在每个界 面上都有2F的正电荷与2F的负电荷通过,反应 后中间区的溶液的离子数目不变。而在阳极区和阴 极区,各减少了2摩尔电荷(的物质)。 i)当u=3u.时,则正离子输送3F,负离子输送 1F,两极的放电数和中间区的离子电荷数不变,阳 极区只剩下2摩尔电荷,阴极区剩下的是4摩尔电 荷的物质,说明正负离子的移动速度不同时,正负离 子分担的导电任务不同

028 (二)离子的迁移数t ① 定义: 某种离子的迁移数为此种离子输送电量的分数, 即某种离子输送的电量与通入的总电量之比· 正离子迁移电量 总电量 9 阳极区正离子迁出的电量 总电量 阳极区减少的电荷量(摩尔) 通入的F数

029 负离子迁移电量 总电量 =g-1 阴极区负离子迁出的电量 总电量 阴极区减少的电荷量(摩尔) 通入的F数 t++t.=1 a u vZF a u.v.Z.F u. 对无限稀溶液也有此关系: U FU=

030 浓度不大时可有 则 +t=+ ,t+t°=1 入=Amt,入:=Amt 实验可测:t+,t~√C 外推,t t,t~√C 外推,t 由实验数据可求出入,入:,也可查表 溶液中有多种离子时, t=g,81,=1,3L+t=1
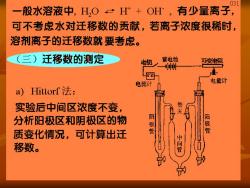
31 一 般水溶液中,H,O+OH,有少量离子, 可不考虑水对迁移数的贡献,若离子浓度很稀时, 溶剂离子的迁移数就要考虑。 (三)迁移数的测定 蓄电池 可变沌阻 电流计 电量计 a)ittorf法: 实验后中间区浓度不变, 管 分析阳极区和阴极区的物 阴极 管 阳极管 质变化情况,可计算出迁 移数。 中间管

032 n始n终二n电解~n迁入二n迁出 n始,n缕可从实验前后的溶液得到,n电解可从电量 计测出的总电量计算出来,由此可得n迁入,迁出。 阳极区减少的量×Z+ t= 通电F数 t 阴极区减少的量×Z 通电F数 n迁出XZ 血迁出 n减少×Z1 t;= 通电F数 n电解 通电F数 Hittorf法原理简单,但由于实验中难免对流、扩散、 振动等引起溶液相混,使结果有偏差,且没考虑 水的迁移数,故称作Hittorf迁移数
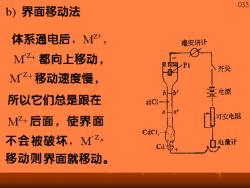
033 b)界面移动法 体系通电后,+, 安培计 M+都向上移动, 开关 Mz+移动速度慢, 兰电源 所以它们总是跟在 M亿+后面,使界面 可变电阻 不会被破坏,M2+ 电魔计 移动则界面就移动

034 通过了q电量之后,界面从b移至b',移动距离 为L,设截面为A,M+的浓度为CMZ4。 在bb'之间原为M+,通q电量后,M+全部 从这个区域移走。则迁移的电量为LACZ+F LACZF ,tA.=1-t 为使界面清楚,应使两种离子的速度尽量接近, 可以用调节浓度来达到。 用此法获得的结果较为精确
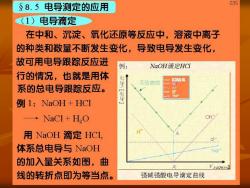
§8.5电导测定的应用 035 (1)电导滴定 在中和、沉淀、氧化还原等反应中,溶液中离子 的种类和数量不断发生变化,导致电导发生变化, 故可用电导跟踪反应进 例: NaOH滴定HCI 行的情况,也就是用体 电 导电导】 实验曲线 系的总电导跟踪反应。 例1:NaOH+HC1 →NaC1+HO 用NaOH滴定HCI, 体系总电导与NaOH 的加入量关系如图,曲 A V.IaoH/ml 线的转折点即为等当点。 强碱强酸电导滴定曲线
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(1/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(12/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(11/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(08/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(07/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(05/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(03/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(02/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(01/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(16/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(15/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(13/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(12/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(11/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(10/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(2/3).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(1/3).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(4/4)相图边界理论及其应用.ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(2/4)二组分气——液体系.ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(1/4).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(3/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(4/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(5/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(6/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(7/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(9/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(1/2,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(1/2,图片版).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)物理化学绪论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.1-1.6).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.7)实际气体、节流过程.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.8)热化学 thermochemistry.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(习题辅导).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.6-2.7)赫氏自由能和吉氏自由能、热力学基本关系式.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.8)△G的计算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.9)多组分体系热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.10-2.11)热力学第三定律、热力学函数的规定值.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.12)非平衡态热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.1-3.3 溶液表示法、理想气体、实际气体、逸度.ppt
