武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.1-1.6)

物理化学 第一章 热力学第一定律
物理化学 第一章 热力学第一定律

热力学第一定律 天长地久 ● 人法地 地法天 天法道 道法自然 ·老子: 6 道德经
• 天长地久 • 人法地 地法天 天法道 道法自然 • 老子:“ 道德经” 热力学第一定律

热力学第一定律 《物质的内能、热力学第一定律 必物质的焓 冬理想气体 必物质的热容 必等温过程、等压过程、绝热过程 必可逆过程、不可逆过程、准静过程 必实际气体、焦汤效应 必热化学
热力学第一定律 ❖ 物质的内能、 热力学第一定律 ❖ 物质的焓 ❖ 理想气体 ❖ 物质的热容 ❖ 等温过程、等压过程、绝热过程 ❖ 可逆过程、不可逆过程、准静过程 ❖ 实际气体、焦汤效应 ❖ 热化学

第一章 热力学第一定律 first law of thermodynamics) 物质的能量:任何物质所包含的能量为: E=U+T+V ·E:物质所含的全部能量,即总能量 ·T:物质具有的宏观动能,如:T=1/2mV2. ·:物质所具有的势能,如重力势能等. U:物质的内能,含粒子的平动能、转动能、振动 能、核运动能量、电子运动能量和分子间势 能等
第一章 热力学第一定律 (first law of thermodynamics) • 物质的能量: 任何物质所包含的能量为: • E = U+T+V • E: 物质所含的全部能量,即总能量. • T: 物质具有的宏观动能, 如: T=1/2·mV2 . • V: 物质所具有的势能, 如重力势能等. • U: 物质的内能,含粒子的平动能、转动能、振动 能、核运动能量、电子运动能量和分子间势 能等

。第一节 热力学第一定律 0一、 热力学第一定律(first law of thermodynamics) ·自然界的能量既不能创生,也不会消天 ·热力学第一定律即为:能量守恒原理 ·更广泛地可定义为: 物质不灭定律。 ·第一定律可表述为: 第一类永动机不可能
• 第一节 热力学第一定律 • 一、热力学第一定律(first law of thermodynamics) • 自然界的能量既不能创生,也不会消灭. • 热力学第一定律即为: 能量守恒原理. • 更广泛地可定义为: 物质不灭定律. • 第一定律可表述为: 第一类永动机不可能
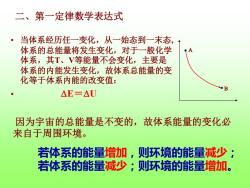
二、第一定律数学表达式 ·当体系经历任一变化,从一始态到一末态, 体系的总能量将发生变化,对于一般化学 体系,其T、V等能量不会变化,主要是 体系的内能发生变化,故体系总能量的变 化等于体系内能的改变值: B △E=△U 因为宇宙的总能量是不变的,故体系能量的变化必 来自于周围环境。 若体系的能量增加,则环境的能量减少; 若体系的能量减少;则环境的能量增加
二、第一定律数学表达式 • 当体系经历任一变化,从一始态到一末态, 体系的总能量将发生变化,对于一般化学 体系,其T、V等能量不会变化,主要是 体系的内能发生变化,故体系总能量的变 化等于体系内能的改变值: • E=U A B 因为宇宙的总能量是不变的,故体系能量的变化必 来自于周围环境。 若体系的能量增加,则环境的能量减少; 若体系的能量减少;则环境的能量增加

体系与环境之间的能量交换形式只有热与功两种,故有: △U=O+W (体系对外做功为负) 上式即为热力学第一定律的数学表达式。 其物理意义是: 自然界的能量是恒定的,若体系的内能 发生了变化(△U),其值必定等于体系与环 境之问能量交换量(Q、W)的总和。 由于功W的符号系统的不同,热力学第一定律也可表示为: △U=Q-W (体系对外做功为正)
由于功W的符号系统的不同,热力学第一定律也可表示为: U =Q-W (体系对外做功为正) 体系与环境之间的能量交换形式只有热与功两种,故有: U =Q+W (体系对外做功为负) 上式即为热力学第一定律的数学表达式。 其物理意义是: 自然界的能量是恒定的,若体系的内能 发生了变化(U),其值必定等于体系与环 境之间能量交换量(Q、W)的总和

建立热力学第一定律的历史背景: 在人们尚未认识到热力学第一定律(即能量 守恒原理)以前,对热量的本质缺乏正确的认 识。当时的科学界普遍认为热是以某中形式存 在的物质,并称之为热素。 物体温度高,意味着所含的热素较多;温度 低,则所含热素少。 当高温物体与低温物体相接触时,热素将从 多的一方流向少的一方,于是,高温物体温度 降低,低温物体温度升高
建立热力学第一定律的历史背景: 在人们尚未认识到热力学第一定律(即能量 守恒原理)以前,对热量的本质缺乏正确的认 识。当时的科学界普遍认为热是以某中形式存 在的物质,并称之为热素。 物体温度高,意味着所含的热素较多;温度 低,则所含热素少. 当高温物体与低温物体相接触时,热素将从 多的一方流向少的一方,于是,高温物体温度 降低,低温物体温度升高

1840年,英国科学家Joule做了一系列实验,证 明了热量就是能量。并从实验数据得出了热功当 量:Joule发现把一磅水提高一华氏度,需消耗 772英尺一磅的机械能,相当于1ca=4.157J。 常用的热量单位是卡(ca): 一克纯水从14.50C升至15.50C所需的热量 热力学所采用的热功当量为: 1cal=4.184J
1840年 ,英国科学家Joule做了一系列实验,证 明了热量就是能量。并从实验数据得出了热功当 量:Joule发现把一磅水提高一华氏度,需消耗 772英尺-磅的机械能,相当于1cal=4.157 J。 常用的热量单位是卡(cal): 一克纯水从14.5 0C升至15.5 0C所需的热量 热力学所采用的热功当量为: 1cal = 4.184 J

第二节 焓(enthalpy) ·一.等压过程和焓 若体系经历一等压过程,且不作有用功由热力 学第一定律: △U=Q+W=Q-p外dV 等压过程: P外=P2P1 ● △U=Q-p1or2(V2-V1) 对上式进行改写: (U2-U)=Q-(P2V2-pV) (U2+p2V2)-(U1+p1V1)=Qp (1)
第二节 焓 (enthalpy) • 一 . 等压过程和焓 • 若体系经历一等压过程,且不作有用功,由热力 学第一定律: • U=Q+W=Q-∫p外dV • 等压过程: p外=p2=p1 • U=Q-p1or2(V2-V1 ) • 对上式进行改写: • (U2-U1 )=Q-(p2V2-p1V1 ) • (U2+p2V2 )-(U1+p1V1 )=Qp (1)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《物理化学》课程教学资源(PPT课件)物理化学绪论.ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(1/2,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(1/2,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(9/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(7/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(6/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(5/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(4/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(3/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(2/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(1/13,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(12/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(11/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(08/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(07/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(05/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(03/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(02/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(01/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(16/17,图片版).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.7)实际气体、节流过程.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(1.8)热化学 thermochemistry.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律(习题辅导).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.6-2.7)赫氏自由能和吉氏自由能、热力学基本关系式.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.8)△G的计算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.9)多组分体系热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.10-2.11)热力学第三定律、热力学函数的规定值.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.12)非平衡态热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.1-3.3 溶液表示法、理想气体、实际气体、逸度.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.4 理想溶液(ideal solutiom).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.5-3.6 理想稀溶液 ideal dilute solution、稀溶液的依数性.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.7-3.8 吉布斯-杜亥姆方程(Gibbs-Duhem Function)、非理想溶液.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.9-3.11 渗透系数、超额函数(excess function)、分配定律.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.1)相律(phase law).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.2)单组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.3)双液系相图 liqiud-liqiud phase diagram.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.6)三组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第一节 化学反应的方向和限度 第二节 化学反应平衡常数.ppt
