武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(分子配分函数)

分子配分数
分子配分函数

§5. 分子配分函数 q的分解: 分子的运动:核自旋运动,电子运动,平动,转动,振动 分子的各种运动可以近似认为是各自独立的,故可以分解: q=∑e-∈ik灯 =(②e∈k(∑eek.(∑ee),(e∈k,∑e∈Ty q=qn.qe-qrqrqv 因为热力学函数与q的对数相关,故热力学函数值是各分运动 形式对热力学函数贡献值的如和: F=-NKTInq=-NkTInq-NkTInqe-NKTInq-NKTInqr-NkTInqy F=Fn+F。+F+F+F、 (2)
§5. 分子配分函数 q 的分解: 分子的运动:核自旋运动,电子运动,平动, 转动, 振动. 分子的各种运动可以近似认为是各自独立的,故可以分解: q = Σe-∈i/kT =(∑e-∈i/kT) n (∑e-∈i/kT) e (∑e-∈i/kT) t (∑e-∈i/kT) r (∑e-∈i/kT)v q = qn .qe .qt .qr .qv (1) 因为热力学函数与q的对数相关,故热力学函数值是各分运动 形式对热力学函数贡献值的加和: F=-NkT㏑q=-NkT㏑qn -NkT㏑qe -NkT㏑qt -NkT㏑qr -NkT㏑qv F=Fn +Fe +Ft +Fr +Fv (2)

一、核配分函数: 原子核各运动能级间距非常大. qn=∑g:e-Ei/kT =goe∈okT(1+g1/goe(∈1-∈0kT+.tg/ge△∈ikT+.) .'△∈>>kT .eA∈ikT≈0 qn=goe-∈0kT (3) 令∈=0 9n=g0=2Sn+1 (4) S:核自旋量子数 gm:在一般情况下为常数 核配分函数是一常数,等于基态能级的简并度
一 、核配分函数: 原子核各运动能级间距非常大. qn=∑gie -i /kT = g0 e -0/kT(1+ g1 /g0 e -(∈1-∈0)/kT+.+gi /g0 e -△∈i /kT +.) ∵ i>>kT ∴ e -i /kT ≈ 0 ∴ qn = g0 e-∈0 /kT (3) 令∈0 = 0 qn = g0 =2Sn +1 (4) Sn : 核自旋量子数 gn : 在一般情况下为常数 核配分函数是一常数, 等于基态能级的简并度

二、电子配分函数: 电子配分函数的情况一般与核配分函数类似 qe=ze-∈kT =goe-∈kT(1+g1/ge-△∈MT+.) g0e-∈akT (5) 令∈=0 9e=g0=2J+1 (6) J:电子总轨道角动量量子数 大多数分子J=0,g=1. He Na Ti Pb CI J: 0 2 h 0 3/2 g0: 1 2 2 1 4
二.电子配分函数: 电子配分函数的情况一般与核配分函数类似. qe=Σe-∈i/kT = g0 e-∈0/kT(1+ g1 /g0 e-△∈i/kT+.) ≈g0 e-∈0/kT (5) 令∈0 =0 qe = g0 = 2J +1 (6) J:电子总轨道角动量量子数. 大多数分子 J =0,g =1. He Na Ti Pb Cl J: 0 ½ ½ 0 3/2 g0 e : 1 2 2 1 4

三·平动配分函数: 平动:分子质心的运动 因为一定条件下气体体系的热力学函数值与其形状无关,不妨将 气体体系的形状规定为一方箱分子的平动等同于一粒子在三 维势箱中的运动, 三维势箱中的粒子运动的能级公式为: ∈=h2/8mn2/a2+n2b2+n21c2) nx,n,nz:三个轴方向的平动量子数; h:普朗克常数. nx=1,2,3, . ny=1,2,3, nz=1,2,3,. 均为正整数
三.平动配分函数: 平动:分子质心的运动 因为一定条件下气体体系的热力学函数值与其形状无关, 不妨将 气体体系的形状规定为一方箱.分子的平动等同于一粒子在三 维势箱中的运动. 三维势箱中的粒子运动的能级公式为: ∈t =h2 /8m(nx 2 /a2 + ny 2 /b2 + nz 2 /c2 ) nx , ny , nz : 三个轴方向的平动量子数; h: 普朗克常数. nx =1, 2, 3, . ny =1, 2, 3, . nz =1, 2, 3, . 均为正整数

。∈t=h2/8(nx2/a2+n2b2+n,2/c2) 。f 能级的简并度:设a=b=c ·最低能级:∈,=h2/8mx3/a2=3e ● g0=1(nx=1,ny=1,n,=1) 第一激发能级:∈,=h2/8m×6/a2=6e n=1,ny=1,n2 第二激发能级:∈=h28m×9/a2=9e fnx=2,y-2,n=1 g2=3 nx=2,y=1,=2 nx=1,ny=2,nz=2
• ∈t =h2 /8m(nx 2 /a2 + ny 2 /b2 + nz 2 /c2 ) • 能级的简并度:设a=b=c • 最低能级:∈t =h2 /8m3/a2=3e • g0=1 (nx=1, ny=1, nz=1 ) • 第一激发能级:∈t =h2 /8m6/a2=6e • nx=2, ny=1, nz=1 • g1=3 nx=1, ny=2, nz=1 • nx=1, ny=1, nz=2 • 第二激发能级:∈t =h2 /8m9/a2=9e • nx=2, ny=2, nz=1 • g2=3 nx=2, ny=1, nz=2 • nx=1, ny=2, nz=2

q=∑e 6 ∑ 足+) 8mk a nx,ny,n: h2 ng h2 ny h2 n2 =∑e 8mk a)(e 8m∑e 8mkt c2) nx ny n. h2 ng ∑ 8mkt a? =∑e 其中2=h2/8mkTa2 n. q Jo 2mkt a 2a
qt = = = qt x = = 其中 α 2 =h2 /8mkTa2 qt x≈ = = − + + y z x y z n n c n b n a n mkt h e n , , ( ) 8 x 2 2 2 2 2 2 2 kt t i / i e − ( ) ( ) ( ) 2 2 2 2 2 2 2 2 2 8 8 8 − − − z z y y x x n c n mkt h n b n mkt h n a n mkt h e e e − x x n a n mkt h e 2 2 2 8 − x x n a n e 2 2 2 a h m kt 2 2 2 2 0 nx x e dn −
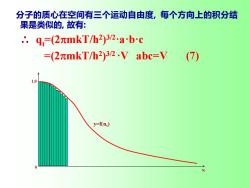
分子的质心在空间有三个运动自由度,每个方向上的积分结 果是类似的,故有: ∴.q=(2元mkT/h2)32abc =(2mkT/h2)322.V abc=V (7) 10 y=f()
分子的质心在空间有三个运动自由度, 每个方向上的积分结 果是类似的, 故有: ∴ qt=(2mkT/h2 ) 3/2·a·b·c =(2mkT/h2 ) 3/2·V abc=V (7) N 0 1.0 y=f(nx )

平动对热力学函数的贡献: 1.U: U=NKT2 [olnq/OT]N,v =NkT2{a/OTIn[(2πmk/h2)32V·(T)32]}y =NkT2·3/2:1/T=3/2nRT Um=3/2RT (8) 2.Cvm: Cv.m=(OU/OT)v=3/2R (9) 单原子分子只有平动,CXm:3/2R. 与统计力学推出的结果完全一致. 3.F: F=-NKT.In(eq/N) =-nRT-In[(e/N)(2rmkT /h2 )3/2.V] (10)
平动对热力学函数的贡献: 1. U: U=NkT2 [∂lnq/∂T]N,V =NkT2 {∂/∂Tln[(2mk/h2 ) 3/2 ·V·(T)3/2 ]}N,V = NkT2 ·3/2·1/T = 3/2nRT Um = 3/2RT (8) 2. CV,m: CV,m=(∂U/∂T)V=3/2R (9) 单原子分子只有平动, CVm = 3/2R. 与统计力学推出的结果完全一致. 3. F: F= -NkT·ln(eq/ N) = -nRT·ln[(e/N)( 2mkT /h2 ) 3/2·V] (10)

4.S: S=(U-F)/T=(1/T)(3/2nRT)+1/T)NkTIn(eq/N) =3/2nR+Nkln [(e/N)(2rmkT/h2)32.V] V=RT/p,m=M/NA St.m=R{In [(2kt/h2)32k/NA2.p]+3/2InM+5/2InT-In(p/p)+5/2) S.m=R[3/2InM+5/2InT-In(p/p)-1.165] (11) (11)式为沙克尔一特鲁德公式,单位是J.K1.mo1其中: M: 相对分子量; T: 绝对温度; p/p:压力比
4. S: S=(U-F)/T =(1/T)(3/2nRT)+(1/T)NkT㏑(eq/N) =3/2nR+Nk㏑[(e/N)(2mkT/h2 ) 3/2·V] ∵ V=RT/p, m=M/NA St.m =R{㏑[(2k/h2 ) 3/2k/NA 2·p0 ]+3/2lnM+5/2lnT-㏑(p/p0 )+5/2} St.m = R[3/2lnM + 5/2lnT-ln(p/p0 )-1.165] (11) (11)式为沙克尔-特鲁德公式,单位是J.K-1 .mol-1 .其中: M: 相对分子量; T: 绝对温度; p/p0 : 压力比
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(量子统计法、Boltzmann分布律).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(系综理论、配分函数、理想气体统计理论).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(热力学的统计基础).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第五节 实例分析.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第四节 外界因素对化学平衡的影响.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第三节 平衡常数的求算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第一节 化学反应的方向和限度 第二节 化学反应平衡常数.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.6)三组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.3)双液系相图 liqiud-liqiud phase diagram.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.2)单组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.1)相律(phase law).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.9-3.11 渗透系数、超额函数(excess function)、分配定律.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.7-3.8 吉布斯-杜亥姆方程(Gibbs-Duhem Function)、非理想溶液.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.5-3.6 理想稀溶液 ideal dilute solution、稀溶液的依数性.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.4 理想溶液(ideal solutiom).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.1-3.3 溶液表示法、理想气体、实际气体、逸度.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.12)非平衡态热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.10-2.11)热力学第三定律、热力学函数的规定值.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(物质的热容理论、理想气体化学势).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(化学反应平衡常数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学动力学的任务和目的).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应速率).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应的速率方程、积分速率方程-具有简单级数的反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(温度对反应速率的影响).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(几种典型的复杂反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(链反应及复杂反应动力学近似处理).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(传递现象 Transport Phenomenon).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(1/6)碰撞理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(2/6)碰撞理论在溶液反应中的应用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(3/6)过渡态理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(4/6)原盐效应.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(5/6)单分子反应理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(6/6)分子反应动态学(molecular reaction dynamics).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(1/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(2/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(1/3)电化学(Electrochemistry)绪论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(2/3)电导(Electric Conductance).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(3/3)强电解质溶液理论简介.ppt
