武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(2/6)碰撞理论在溶液反应中的应用

碰撞理论在溶液反应中的应用
碰撞理论在溶液反应中的应用

溶剂对反应速率的影响 溶剂对反应速率的影响十分复杂: (1)溶剂介电常数的影响 (2)溶剂极性的影响 (3)溶剂化的影响 (4)离子强度的影响
溶剂对反应速率的影响 溶剂对反应速率的影响十分复杂: (1)溶剂介电常数的影响 (2)溶剂极性的影响 (3)溶剂化的影响 (4)离子强度的影响
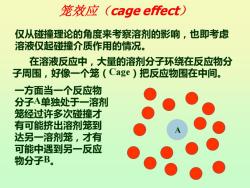
笼效应(cage effect.) 仅从碰撞理论的角度来考察溶剂的影响,也即考虑 溶液仅起碰撞介质作用的情况。 在溶液反应中,大量的溶剂分子环绕在反应物分 子周围,好像一个笼(Cage)把反应物围在中间。 一方面当一个反应物 分子A单独处于一溶剂 笼经过许多次碰撞才 有可能挤出溶剂笼到 达另一溶剂笼,才有 可能中遇到另一反应 物分子B
笼效应(cage effect) 仅从碰撞理论的角度来考察溶剂的影响,也即考虑 溶液仅起碰撞介质作用的情况。 A 在溶液反应中,大量的溶剂分子环绕在反应物分 子周围,好像一个笼(Cage)把反应物围在中间。 一方面当一个反应物 分子A单独处于一溶剂 笼经过许多次碰撞才 有可能挤出溶剂笼到 达另一溶剂笼,才有 可能中遇到另一反应 物分子B

笼效应(cage effect)
笼效应(cage effect)

笼效应(cage effect) 另一方面当反应物分子A、B处于同一溶剂笼 时将发生许多次连续重复的碰撞,称为一次遭遇, 此时A、B碰撞频率很高。 即虽然A、B相遇几率变低,当一旦相遇即具 有很高的碰撞频率,总体看来其碰撞频率并不低于 气相反应中的碰撞频率,因而发生反应的机会也较 多,这种现象称为笼效应 每次遭遇在笼中停留的时间约为102~10"s, 进行约100~1000次碰撞,频率与气相反应近似
另一方面当反应物分子A 、 B处于同一溶剂笼 时将发生许多次连续重复的碰撞,称为一次遭遇, 此时 A 、 B碰撞频率很高。 即虽然A 、 B相遇几率变低,当一旦相遇即具 有很高的碰撞频率,总体看来其碰撞频率并不低于 气相反应中的碰撞频率,因而发生反应的机会也较 多,这种现象称为笼效应 每次遭遇在笼中停留的时间约为10-12~10-11 s , 进行约100~1000次碰撞,频率与气相反应近似。 笼效应(cage effect)
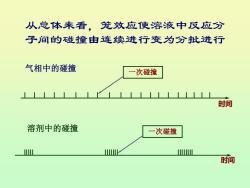
从总体来看,笼效应使溶液中反应分 子间的碰撞由连续进行变为分批进行 气相中的碰撞 一次碰撞 时间 溶剂中的碰撞 次碰撞 皿 时间
从总体来看,笼效应使溶液中反应分 子间的碰撞由连续进行变为分批进行 气相中的碰撞 时间 一次碰撞 溶剂中的碰撞 一次碰撞 时间

笼效应(cage effect.) 对活化能较大的反应 ,也即有效碰撞分数较小的 反应,笼效应对其反应影响不大。 N20s→2N02+1/202 k×105/s1 IgA Ea /kJ.mol-1 气相 3.4 13.6 103 CCI 4.1 13.8 107 Br2 (1) 4.3 13.3 100 对活化能很小的反应,一次碰撞就有可能反应,则 笼效应会使这种反应速率变慢,此时反应速率取决于遭 遇对的形成,即分子的扩散速度起了速决步的作用
对活化能较大的反应,也即有效碰撞分数较小的 反应,笼效应对其反应影响不大。 笼效应(cage effect) 对活化能很小的反应,一次碰撞就有可能反应,则 笼效应会使这种反应速率变慢,此时反应速率取决于遭 遇对的形成,即分子的扩散速度起了速决步的作用。 k×105 /s-1 lgA Ea / kJ·mol-1 气相 3.4 13.6 103 CCl4 4.1 13.8 107 Br2 (l) 4.3 13.3 100 N2O5 → 2NO2 + 1/2O2

溶液反应 溶液中进行的反应,可认为经历如下步骤: A+B kA:B k.d A:B kr P 即反应物分子A与B经扩散来到同一个笼中形成偶遇对 A:B,偶遇对A:B可能发生反应生成产物P,也可能不发 生反应重新分离为A和B。 ·若认为A:B的浓度可达稳态,有: d4:B]=k[[B]-kA:B]-k[4:B]=0 dt 4:B]=kLAB]
溶液中进行的反应,可认为经历如下步骤: A + B A:B kd k-d A:B P kr • 即反应物分子A 与 B 经扩散来到同一个笼中形成偶遇对 A:B,偶遇对A:B 可能发生反应生成产物P,也可能不发 生反应重新分离为 A 和 B。 • 若认为A:B 的浓度可达稳态,有: [ ][ ] [ : ] [ : ] 0 [ : ] = k A B − k− A B − k A B = dt d A B d d r d r d k k k A B A B + = − [ ][ ] [ : ] 溶液反应

溶液反应 了反应总速率为: k,ka(AllB] k.ka r=k,LA:B]=ka+kr ∴.k= k-d+kr 。当k妇>>k,即化学反应速率很小时: ,ka=K·k, k=k'kd 。K可视为生成分子对A:B的反应平衡常数。这 种反应是动力学控制的,反应活化能一般Ea> 80 kJ.mol1
反应总速率为: [ : ] [A][B] k k k k r k A B d r r d r + = = − d r r d k k k k k + = − • 当 k-d >> kr ,即化学反应速率很小时: r d d r K k k k k = k = − • K 可视为生成分子对 A:B 的反应平衡常数。这 种反应是动力学控制的,反应活化能一般 Ea > 80 kJ·mol-1 。 溶液反应

扩散控制反应 k.kd k=kdtkr ·当k>ka时 .k=kd .r=][B] 扩散控制反应的活化能一般比较小,一旦生成A:B分子对便 立即反应生成产物。故反应速率取决于扩散速度。 ·按Fick's forst law: J=-DR ·DB:B分子的扩散系数NB:单位体积中B的分子数 ·J:单位时间通过单位截面的B分子的流量
d r r d k k k k k + = − • 当 kr >> k-d 时 d k = k r k [A][B] = d • 按 Fick’s forst law : dr dN J D B = − B • DB:B 分子的扩散系数 NB:单位体积中B 的分子数 • J:单位时间通过单位截面的B 分子的流量。 扩散控制反应 扩散控制反应的活化能一般比较小,一旦生成 A:B 分子对便 立即反应生成产物。故反应速率取决于扩散速度
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(1/6)碰撞理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(传递现象 Transport Phenomenon).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(链反应及复杂反应动力学近似处理).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(几种典型的复杂反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(温度对反应速率的影响).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应的速率方程、积分速率方程-具有简单级数的反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应速率).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学动力学的任务和目的).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(化学反应平衡常数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(物质的热容理论、理想气体化学势).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(分子配分函数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(量子统计法、Boltzmann分布律).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(系综理论、配分函数、理想气体统计理论).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(热力学的统计基础).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第五节 实例分析.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第四节 外界因素对化学平衡的影响.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第三节 平衡常数的求算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第一节 化学反应的方向和限度 第二节 化学反应平衡常数.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.6)三组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.3)双液系相图 liqiud-liqiud phase diagram.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(3/6)过渡态理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(4/6)原盐效应.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(5/6)单分子反应理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(6/6)分子反应动态学(molecular reaction dynamics).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(1/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(2/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(1/3)电化学(Electrochemistry)绪论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(2/3)电导(Electric Conductance).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(3/3)强电解质溶液理论简介.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §6 溶胶的稳定性和聚沉作用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §1 可逆电池和不可逆电池.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §2 可逆电池的热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §3 电动势产生的机理.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §4 平衡电极电势和电池电动势 §5 可逆电极的种类.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §6 可逆电池电动势的计算 §7 电动势的测量.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §8 电动势测定的应用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十二章 不可逆电极过程 §1 不可逆电极过程中的电极极化.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十二章 不可逆电极过程 §2 电解时的电极反应.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十二章 不可逆电极过程 §3 金属的电化学腐蚀和保护.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十二章 不可逆电极过程 §4 化学电源.ppt
