武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(温度对反应速率的影响)

温度对反应速率的影响
温度对反应速率的影响

范霍夫(van'tHo)近似规律 范霍夫根据大量的实验数据总结出一条经验规律: 温度每升高10K,反应速率近似增加24倍。 这个经验规律可以用来估计温度对反应速率的影响。 例如:某乳品在4度时保质期为7天,估计在常温下可保存多久? 解:取每升高10K,速率增加的下限为2倍。 k(298K)t(277K) ≈22=4 k(277K)t(298K) t(298K)=7/4=1.75d
范霍夫(van’t Hoff)近似规律 范霍夫根据大量的实验数据总结出一条经验规律: 温度每升高10 K,反应速率近似增加2~4倍。 这个经验规律可以用来估计温度对反应速率的影响。 例如:某乳品在4度时保质期为7天,估计在常温下可保存多久? 2 (298 K) (277 K) 2 4 (277 K) (298 K) k t k t = = 解:取每升高10 K,速率增加的下限为2倍。 t(298 K) 7 / 4 1.75 d = =
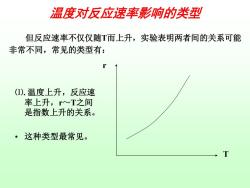
温度对反应速率影响的类型 但反应速率不仅仅随T而上升,实验表明两者间的关系可能 非常不同,常见的类型有: (1).温度上升,反应速 率上升,r~T之间 是指数上升的关系。 ·这种类型最常见。 T
温度对反应速率影响的类型 但反应速率不仅仅随T而上升,实验表明两者间的关系可能 非常不同,常见的类型有: r T ⑴. 温度上升,反应速 率上升,r~T之间 是指数上升的关系。 • 这种类型最常见
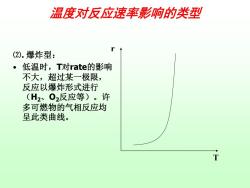
温度对反应速率影响的类型 (2).爆炸型: 。低温时,T对rate的影响 不大,超过某一极限, 反应以爆炸形式进行 (H2、02反应等)。许 多可燃物的气相反应均 呈此类曲线。 T
⑵. 爆炸型: • 低温时,T对rate的影响 不大,超过某一极限, 反应以爆炸形式进行 (H2、O2反应等)。许 多可燃物的气相反应均 呈此类曲线。 T r 温度对反应速率影响的类型

温度对反应速率影响的类型 ·(3).先升后降型: 多相催化常呈此类型:温 度不高时,反应速率随T 而增加,达到一定温度后, 催化剂活性受到影响,速 率反而变慢。酶催化反应 也如此,这与酶在高温下 失活有关。 T
• ⑶. 先升后降型: • 多相催化常呈此类型:温 度不高时,反应速率随T 而增加,达到一定温度后, 催化剂活性受到影响,速 率反而变慢。酶催化反应 也如此,这与酶在高温下 失活有关。 r T 温度对反应速率影响的类型
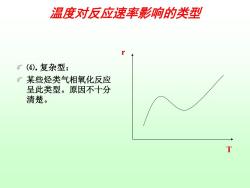
温度对反应速率影响的类型 了(④).复杂型: 了某些烃类气相氧化反应 呈此类型。原因不十分 清楚。 T
温度对反应速率影响的类型 ⑷. 复杂型: 某些烃类气相氧化反应 呈此类型。原因不十分 清楚。 r T

温度对反应速率影响的类型 ·(5).下降型: 如2N0+02 +2N02 在183~773K内,k随T 的升高而降低, ·T>773K时,k几乎不变。 7 上述结果说明,从宏观角度来看,温度对反应速率的影响 是很复杂的,在后面学习阿仑尼乌斯公式时应注意不要将 其应用范围无限扩大
• ⑸. 下降型: • 如2NO + O2 2NO2 在183~773K内,k 随T 的升高而降低, • T >773K时,k 几乎不变。 r T 温度对反应速率影响的类型 上述结果说明,从宏观角度来看,温度对反应速率的影响 是很复杂的,在后面学习阿仑尼乌斯公式时应注意不要将 其应用范围无限扩大

阿仑尼乌斯公式 ·因第一类型最常见,现以第一类型为主进行讨论。 实验证明,反应速度与反应速率常数k相关,k愈大,rate愈快。 一般反应的nk~1/T呈一直线关系。 Ea .nk= 1+B 网仑尼乌斯公式 a k=Aexp(-RT
•因第一类型最常见,现以第一类型为主进行讨论。 •实验证明,反应速度与反应速率常数 k 相关,k 愈大,rate愈快。 •一般反应的lnk~1/T 呈一直线关系。 阿仑尼乌斯公式 B R T Ea k = − + 1 ln exp( ) RT E k A a = − 阿仑尼乌斯公式

阿仑尼乌斯(Arrhenius)公式 k=Aep(-) A称为指前因子,(pre-exponential I factor) A具有与反应速率常数相同的量纲,碰撞理论 告诉我们,其物理意义为反应物分子间的碰撞频率 Ea称为阿仑尼乌斯活化能,(Activation Energy) 指数项exp(-En/RT)决定了有效碰撞分数,也 即引发反应的碰撞占全部碰撞的百分比,不难看出, Ea的数值对反应速率常数影响非常大。 阿仑尼乌斯认为A和Ea都是与温度无关的常数
阿仑尼乌斯(Arrhenius)公式 exp( ) RT E k A a = − A 称为指前因子,( pre-exponential factor) A 具有与反应速率常数相同的量纲,碰撞理论 告诉我们,其物理意义为反应物分子间的碰撞频率 阿仑尼乌斯认为A和Ea 都是与温度无关的常数。 Ea 称为阿仑尼乌斯活化能, (Activation Energy) 指数项 决定了有效碰撞分数,也 即引发反应的碰撞占全部碰撞的百分比,不难看出, Ea的数值对反应速率常数影响非常大。 exp( ) −E RT a

阿仑尼乌斯公式还有如下常用变换形式 (1) In= E +In 4 RT 利用此式,可以根据不同温度下测定的k值,以 Ink对1T作图,从而求出活化能Ea。 (2) 会喷名 由此式,根据两个不同温度下的k值求活化能。或者 在已知活化能的情况下,求解某一温度下的速率常数
(1) a ln ln E k A RT = − + 利用此式,可以根据不同温度下测定的 k 值,以 lnk 对 1/T 作图,从而求出活化能 Ea 。 阿仑尼乌斯公式还有如下常用变换形式 (2) ) 1 1 ln ( 1 1 2 2 R T T E k k = − a 由此式,根据两个不同温度下的 k 值求活化能。或者 在已知活化能的情况下,求解某一温度下的速率常数
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应的速率方程、积分速率方程-具有简单级数的反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应速率).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学动力学的任务和目的).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(化学反应平衡常数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(物质的热容理论、理想气体化学势).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(分子配分函数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(量子统计法、Boltzmann分布律).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(系综理论、配分函数、理想气体统计理论).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(热力学的统计基础).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第五节 实例分析.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第四节 外界因素对化学平衡的影响.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第三节 平衡常数的求算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第一节 化学反应的方向和限度 第二节 化学反应平衡常数.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.6)三组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.3)双液系相图 liqiud-liqiud phase diagram.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.2)单组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.1)相律(phase law).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.9-3.11 渗透系数、超额函数(excess function)、分配定律.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.7-3.8 吉布斯-杜亥姆方程(Gibbs-Duhem Function)、非理想溶液.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(几种典型的复杂反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(链反应及复杂反应动力学近似处理).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(传递现象 Transport Phenomenon).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(1/6)碰撞理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(2/6)碰撞理论在溶液反应中的应用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(3/6)过渡态理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(4/6)原盐效应.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(5/6)单分子反应理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(6/6)分子反应动态学(molecular reaction dynamics).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(1/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(2/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(1/3)电化学(Electrochemistry)绪论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(2/3)电导(Electric Conductance).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(3/3)强电解质溶液理论简介.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §6 溶胶的稳定性和聚沉作用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §1 可逆电池和不可逆电池.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §2 可逆电池的热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §3 电动势产生的机理.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §4 平衡电极电势和电池电动势 §5 可逆电极的种类.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §6 可逆电池电动势的计算 §7 电动势的测量.ppt
