武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应速率)

反应速率(rate of reaction) 1d5 y dt
1 d d r V t = 反应速率(rate of reaction)

化学反应速率 反应速率的符号 例如: R→P 反应物减少,产物增多,故而: dR]0 dt dt
化学反应速率 反应速率的符号 d[R] d[P] 0 0 d d t t d[R] d[P] = 0 d d r t t − = 例如: R P ⎯⎯→ 反应物减少,产物增多,故而: 但反应速率不能为负,故定义反应速率时是按照单位时间 反应物的减少或产物的增加来定义的
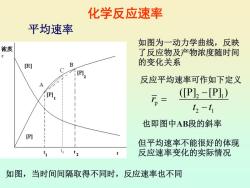
化学反应速率 平均速率 如图为一动力学曲线,反映 浓度 了反应物及产物浓度随时间 [R] B 的变化关系 [P] 反应平均速率可作如下定义 A [P] (P]2-[P]) t2-t1 也即图中AB段的斜率 [P] 但平均速率不能很好的体现 ti t 反应速率变化的实际情况 如图,当时间间隔取得不同时,反应速率也不同
化学反应速率 2 1 p 2 1 ([P] [P] ) r t t − = − 平均速率 如图为一动力学曲线,反映 了反应物及产物浓度随时间 的变化关系 反应平均速率可作如下定义 也即图中AB段的斜率 C t3 但平均速率不能很好的体现 反应速率变化的实际情况 如图,当时间间隔取得不同时,反应速率也不同
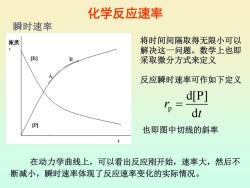
化学反应速率 瞬时速率 浓度 将时间间隔取得无限小可以 解决这一问题。数学上也即 [R] 采取微分方式来定义 反应瞬时速率可作如下定义 d[P] p= dt (P] 也即图中切线的斜率 在动力学曲线上,可以看出反应刚开始,速率大,然后不 断减小,瞬时速率体现了反应速率变化的实际情况
化学反应速率 p d[P] d r t = 在动力学曲线上,可以看出反应刚开始,速率大,然后不 断减小,瞬时速率体现了反应速率变化的实际情况。 瞬时速率 将时间间隔取得无限小可以 解决这一问题。数学上也即 采取微分方式来定义 反应瞬时速率可作如下定义 也即图中切线的斜率

化学反应速率 化学计量关系对反映速率的影响 N2+3H2→2NH3 时刻 [N2 [H2 [NH3] t+dt [N2]-d[N2][H2]-d[H2] [NH3]+d[NH3] 显然,dH2=3dN2] d[NH]=2d[N2] 对于N2: s、 d[N2] dt 对于H2:1 d(H2] 2三一 dt 对于NH3: d[NH;] 3=3r5=2所 dt
化学反应速率 2 2 3 N H NH + ⎯⎯→ 3 2 t时刻 [N2 ] [H2 ] [NH3 ] t+dt [N2 ]-d[N2 ] [H2 ]-d[H2 ] [NH3 ]+d[NH3 ] 显然,d[H2 ]=3d[N2 ] d[NH3 ]=2d[N2 ] 对于 N2: 2 1 d N[ ] r dt = − 对于 H2: 2 2 d H[ ] r dt = − 对于 NH3: 3 3 d NH [ ] r dt = 2 1 3 1 r r r r = = 3 2 化学计量关系对反映速率的影响

反应速率(rate of reaction) 反应进度这一概念有助于解决这一问题,综上我们 给出反应速率的定义为: (d5= 1 dg 1 V dt B dt 对任何反应:eE+P=gG+hH 1d[E]-1d[F]-1dG-1d[H e dt f dt g dt h dt
B B 1 d d c t = 反应进度这一概念有助于解决这一问题,综上我们 给出反应速率的定义为: 1 d d r V t = B B 1 d / d n V t = 1 d[E] 1 d[F] 1 d[G] 1 d[H] d d d d r e t f t g t h t = − = − = = 对任何反应: E F G H e f g h + = + 反应速率(rate of reaction) B B d (d ) n =

总包反应(overall reaction) 若某反应,其化学方程式只代表反应的化学 计量式,而并不代表反应的真正历程。那这种反 应称为总包反应或总反应。 例如,下述反应为总包反应: H2+C12→2HC1 其真实反应历程如下页
总包反应(overall reaction) 若某反应,其化学方程式只代表反应的化学 计量式,而并不代表反应的真正历程。那这种反 应称为总包反应或总反应。 H Cl 2HCl 2 2 + ⎯⎯→ 例如,下述反应为总包反应: 其真实反应历程如下页

基元反应(elementary reaction) C1,+M=2C1+M C1+H2=HC1+H H+C1,=HC1+CI 2C1+M=C1,+M 上面的反应其化学方程式代表代表了一个实际的分 子碰撞反应的过程。这种反应称为基元反应 注意:对于基元反应,其反应方程计量关系是不能随意 按比例扩大缩小的
基元反应(elementary reaction) 上面的反应其化学方程式代表代表了一个实际的分 子碰撞反应的过程。这种反应称为基元反应 2Cl M Cl M H Cl HCl Cl Cl H HCl H Cl M 2Cl M 2 2 2 2 + = + + = + + = + + = + 注意:对于基元反应,其反应方程计量关系是不能随意 按比例扩大缩小的

反应分子数(molecularity of reaction) 在基元反应中,实际参加反应的分子数目称为 反应分子数。反应分子数只可能是简单的正整数1, 2或3。 基元反应 反应分子数 A→P 单分子反应 A+B- 双分子反应 2A+B→P 三分子反应 原因:多分子同时碰撞的几率极小
反应分子数(molecularity of reaction) 在基元反应中,实际参加反应的分子数目称为 反应分子数。反应分子数只可能是简单的正整数1, 2或3。 2A B P A B P A P + ⎯→ + ⎯→ ⎯→ 基元反应 单分子反应 双分子反应 三分子反应 反应分子数 原因:多分子同时碰撞的几率极小

反应机理( (reaction mechanism) 反应机理又称为反应历程。在总反应中,连续 或同时发生的所有基元反应称为反应机理,在有些 情况下,反应机理还要给出所经历的每一步的立体 化学结构图。 同一反应在不同的条件下,可有不同的反应机 理。了解反应机理可以掌握反应的内在规律,从而 更好的驾驭反应
反应机理(reaction mechanism) 反应机理又称为反应历程。在总反应中,连续 或同时发生的所有基元反应称为反应机理,在有些 情况下,反应机理还要给出所经历的每一步的立体 化学结构图。 同一反应在不同的条件下,可有不同的反应机 理。了解反应机理可以掌握反应的内在规律,从而 更好的驾驭反应
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学动力学的任务和目的).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(化学反应平衡常数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(物质的热容理论、理想气体化学势).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(分子配分函数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(量子统计法、Boltzmann分布律).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(系综理论、配分函数、理想气体统计理论).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(热力学的统计基础).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第五节 实例分析.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第四节 外界因素对化学平衡的影响.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第三节 平衡常数的求算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第一节 化学反应的方向和限度 第二节 化学反应平衡常数.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.6)三组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.3)双液系相图 liqiud-liqiud phase diagram.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.2)单组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.1)相律(phase law).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.9-3.11 渗透系数、超额函数(excess function)、分配定律.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.7-3.8 吉布斯-杜亥姆方程(Gibbs-Duhem Function)、非理想溶液.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.5-3.6 理想稀溶液 ideal dilute solution、稀溶液的依数性.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.4 理想溶液(ideal solutiom).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应的速率方程、积分速率方程-具有简单级数的反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(温度对反应速率的影响).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(几种典型的复杂反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(链反应及复杂反应动力学近似处理).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(传递现象 Transport Phenomenon).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(1/6)碰撞理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(2/6)碰撞理论在溶液反应中的应用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(3/6)过渡态理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(4/6)原盐效应.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(5/6)单分子反应理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(6/6)分子反应动态学(molecular reaction dynamics).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(1/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(2/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(1/3)电化学(Electrochemistry)绪论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(2/3)电导(Electric Conductance).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(3/3)强电解质溶液理论简介.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §6 溶胶的稳定性和聚沉作用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §1 可逆电池和不可逆电池.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §2 可逆电池的热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §3 电动势产生的机理.ppt
