武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(几种典型的复杂反应)
几种典型的复杂反应 对峙反应 Opposite Reaction 平行反应 Parallel Reaction 连续反应 Consecutive Reaction
几种典型的复杂反应 对峙反应 Opposite Reaction 平行反应 Parallel Reaction 连续反应 Consecutive Reaction

对峙反应(Opposite reaction) 在正、逆两个方向均可以进行的反应称为对峙 反应。从理论上说,任何化学反应均为对峙反应, 只是有的反应逆反应很慢,可以忽略不计。 A k之B 1一1型 4+B C+D 2一2型 4+B 2一1型 根据正逆反应的级数,对峙反应表现出多种类型,其宏 观动力学方程也有所差别
对峙反应(Opposite Reaction) 在正、逆两个方向均可以进行的反应称为对峙 反应。从理论上说,任何化学反应均为对峙反应, 只是有的反应逆反应很慢,可以忽略不计。 1 1 2 2 2 1 k k k k k k A B A B C D A B C − − − ⎯⎯ ⎯⎯→ + + ⎯⎯ ⎯⎯→ + ⎯⎯ ⎯⎯→ 1-1型 2-2型 2-1型 根据正逆反应的级数,对峙反应表现出多种类型,其宏 观动力学方程也有所差别

我们以1-1级对峙反应为例,考查对峙反应的特点 A B t=0 [Alo 0 t=t [A] [B] d A] =F-6=k[A]-k1B] dt 显然,对峙反应的净速率等于正向速率减去逆向速率 考查上述方程,可以看出,随着反应进行,正反应速率不 断下降,逆反应速率不断上升,直至两者相等,总反应净 速率为零。反应体系在宏观上不再有变化。此时状态即为 我们所熟悉的化学平衡 从动力学角度看,达化学平衡时,化学反应并没有停止, 只是正逆反应速率相等,宏观上其效果被抵消
f b 1 1 d[A] [ ] [ ] d r r r k A k B t = − = − = − − 显然,对峙反应的净速率等于正向速率减去逆向速率 我们以1-1级对峙反应为例,考查对峙反应的特点 t =0 [A]0 0 t =t [A] [B] 1 1 A B k k− ⎯⎯ ⎯⎯→ 考查上述方程,可以看出,随着反应进行,正反应速率不 断下降,逆反应速率不断上升,直至两者相等,总反应净 速率为零。反应体系在宏观上不再有变化。此时状态即为 我们所熟悉的化学平衡 从动力学角度看,达化学平衡时,化学反应并没有停止, 只是正逆反应速率相等,宏观上其效果被抵消

对峙反应达平衡时,有: k[A。-k[B]。=0 kB=K。 k [AJe 上式将热力学平衡常数与动力学速率常 数联系在一起。 思考:将这一公式与阿仑尼乌斯公式中正逆反 应活化能关系式比较并分析对于化学平 衡,请比较我们是如何从热力学和动力学 两个角度来进行研究的,体会从不同角度 看待同一对象
1 1 1 e e e 1 [ ] [ ] 0 [ ] [ ] e c k B K k A k A k B − − − = = = 思考:将这一公式与阿仑尼乌斯公式中正逆反 应活化能关系式比较并分析 对于化学平 衡,请比较我们是如何从热力学和动力学 两个角度来进行研究的,体会从不同角度 看待同一对象 对峙反应达平衡时,有: 上式将热力学平衡常数与动力学速率常 数联系在一起

对峙反应的积分式 (2)求对峙反应积分速率方程 -个友因=个冬动-0 dt 以k-而克 d[A] n+K业-k(+太0 K[A]0 测定了t时刻的反应物浓度[A],已知[A]o和 Kc,就可分别求出k和k1
对峙反应的积分式 测定了t 时刻的反应物浓度[A],已知[A]0和 Kc,就可分别求出k1和k-1。 0 [ ] 1 [ ] 0 0 d[A] d [ ] ([ ] [ ]) A t A c c k t K A A A K = − − 0 1 0 (1 )[ ] [ ] 1 ln (1 ) [ ] c c c K A A k t K A K + − = + 1 1 1 1 0 d[A] [ ] [ ] [ ] ([ ] [ ]) d c c k k k A B k A A A t K K − = − = − − (2) 求对峙反应积分速率方程

4+-L-k0+” K.[4l 将K。=[B]/几A]。=(①A1-[Ae)LA1e代入,得: 1n-L41=k+k [A]-[A。 与一级反应积分 In L4 式比较: 0二kt 1n。-0 [A1-0 kt [A] 1一1型对峙反应可视为趋向于化学平衡的一级反应
将 K B A A A A c e e e e = = − [ ] [ ] ([ ] [ ] ) /[ ] 0 代入,得: 0 1 1 [ ] [ ] ln ( ) [ ] [ ] e e A A k k t A A − − = + − 0 1 0 (1 )[ ] [ ] 1 ln (1 ) [ ] c c c K A A k t K A K + − = + 与一级反应积分 式比较: 0 1 [ ] ln [ ] A k t A = 0 1 [ ] 0 ln [ ] 0 A k t A − = − 1-1型对峙反应可视为趋向于化学平衡的一级反应

对峙反应的特点 1.净速率等于正、逆反应速率之差值 2.达到平衡时,反应净速率等于零 3.正、逆速率常数之比等于平衡常数∈k/k-1
对峙反应的特点 1.净速率等于正、逆反应速率之差值 2.达到平衡时,反应净速率等于零 3.正、逆速率常数之比等于平衡常数K=k1/k-1

对峙反应应用实例一 驰豫法(relaxation method) 当一个体系在一定的外界条件 下达成平衡,然后突然改变一个条 不平衡 件,给体系一个扰动,偏离原平衡, 扰动 弛豫过程 在新的条件下再达成平衡,这就是 驰豫过程。 平衡体系 平衡体系 弛豫(relaxation)这一概念在各个科学领域 中被广泛使用。在化学动力学中驰豫法是用来测 定快速反应速率的一种特殊方法
对峙反应应用实例- 驰豫法(relaxation method) 当一个体系在一定的外界条件 下达成平衡,然后突然改变一个条 件,给体系一个扰动,偏离原平衡, 在新的条件下再达成平衡,这就是 驰豫过程。 弛豫(relaxation)这一概念在各个科学领域 中被广泛使用。在化学动力学中驰豫法是用来测 定快速反应速率的一种特殊方法

弛豫法通过给化学反应体系一个快速的扰动, 使体系发生化学反应弛豫过程,通过测定弛豫过程 地动力学参数一主要是弛豫时间,就可以计算出快 速对峙反应的相关速率常数。 通过使用脉冲激光等方式,可以使得反应体系在数微 秒或更快的时间内改变,因而弛豫法可以测定很快速的化 学反应动力学常数,如酸碱中和反应等。 对平衡体系施加扰动信号的方法可以是脉冲式、 阶跃式或周期式。改变反应的条件可以是温度跃变、 压力跃变、浓度跃变、电场跃变和超声吸收等多种形 式
对平衡体系施加扰动信号的方法可以是脉冲式、 阶跃式或周期式。改变反应的条件可以是温度跃变、 压力跃变、浓度跃变、电场跃变和超声吸收等多种形 式。 弛豫法通过给化学反应体系一个快速的扰动, 使体系发生化学反应弛豫过程,通过测定弛豫过程 地动力学参数-主要是弛豫时间,就可以计算出快 速对峙反应的相关速率常数。 通过使用脉冲激光等方式,可以使得反应体系在数微 秒或更快的时间内改变,因而弛豫法可以测定很快速的化 学反应动力学常数,如酸碱中和反应等
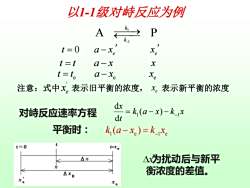
以1-1级对峙反应为例 A k t=0 a-xe t=t a-x X t=te a-xe Xe 注意:式中X。表示旧平衡的浓度,x。表示新平衡的浓度 对峙反应速率方程 dt =k(a-x)-kjx 平衡时: k (a-xe)=k_xe t=0 t-te △x △为扰动后与新平 Axo 衡浓度的差值
以1-1级对峙反应为例 1 -1 A P k k ⎯⎯ ⎯⎯→ 对峙反应速率方程 k a x k x t x 1 1 ( ) d d = − − − 1 e 1 e k (a x ) k x 平衡时: − = − 0 e e t a x x = − t t a x x = − e e e t t a x x = − 注意:式中 表示旧平衡的浓度, 表示新平衡的浓度 ' e x e x 为扰动后与新平 衡浓度的差值。 x
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(温度对反应速率的影响).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应的速率方程、积分速率方程-具有简单级数的反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应速率).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学动力学的任务和目的).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(化学反应平衡常数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(物质的热容理论、理想气体化学势).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(分子配分函数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(量子统计法、Boltzmann分布律).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(系综理论、配分函数、理想气体统计理论).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(热力学的统计基础).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第五节 实例分析.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第四节 外界因素对化学平衡的影响.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第三节 平衡常数的求算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 第一节 化学反应的方向和限度 第二节 化学反应平衡常数.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.6)三组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.3)双液系相图 liqiud-liqiud phase diagram.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.2)单组分相图.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.1)相律(phase law).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液(例题).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 3.9-3.11 渗透系数、超额函数(excess function)、分配定律.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(链反应及复杂反应动力学近似处理).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(传递现象 Transport Phenomenon).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(1/6)碰撞理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(2/6)碰撞理论在溶液反应中的应用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(3/6)过渡态理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(4/6)原盐效应.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(5/6)单分子反应理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(6/6)分子反应动态学(molecular reaction dynamics).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(1/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(2/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(1/3)电化学(Electrochemistry)绪论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(2/3)电导(Electric Conductance).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(3/3)强电解质溶液理论简介.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §6 溶胶的稳定性和聚沉作用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §1 可逆电池和不可逆电池.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §2 可逆电池的热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §3 电动势产生的机理.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §4 平衡电极电势和电池电动势 §5 可逆电极的种类.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §6 可逆电池电动势的计算 §7 电动势的测量.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §8 电动势测定的应用.ppt
