武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(3/3)强电解质溶液理论简介

§3强电解质溶液理论简介 平均活度和平均活度系数 离子强度 强电解质溶液的离子互吸理论
§3 强电解质溶液理论简介 平均活度和平均活度系数 离子强度 强电解质溶液的离子互吸理论

强电解质溶液的活度和活度系数 理想溶液组分B化学势的表示式: me UB=B (T)+RT In 非理想溶液组分B化学势的表示式 =)+RT Inam天(+K心 式中agm=Ymm° YBm→1 当溶液很稀,可看作是理想溶液,YB,m→1,则: B
强电解质溶液的活度和活度系数 理想溶液组分B化学势的表示式: B B B ( ) ln o o m T RT m = + 非理想溶液组分B化学势的表示式 B B B B, ( ) ln o m o m T RT m = + B B, ( ) ln o = + T RT a m B B, B, m m o m a m 式中 = 当溶液很稀,可看作是理想溶液,B,m→1,则: B, 1 m → B B,m o m a m

强电解质溶液的活度和活度系数 对强电解质: (1)强电解质几乎完全电离成离子,整体电解质 不复存在,其浓度与活度的简单关系不再适用: (2)与极稀的非电解质溶液可视作理想(稀)溶液, 活度系数近似等于1不同,对极稀的强电解质溶液, 由于离子间的相互作用,使它比非电解质溶液的 情况复杂得多,此时的活度与理想(稀)溶液的活度 仍有一定的偏差
强电解质溶液的活度和活度系数 对强电解质: (1)强电解质几乎完全电离成离子,整体电解质 不复存在,其浓度与活度的简单关系不再适用; (2)与极稀的非电解质溶液可视作理想(稀)溶液, 活度系数近似等于1不同,对极稀的强电解质溶液, 由于离子间的相互作用,使它比非电解质溶液的 情况复杂得多,此时的活度与理想(稀)溶液的活度 仍有一定的偏差

强电解质溶液的活度和活度系数 对任意价型电解质 M.A→y,M++yA 电解质的化学势e=g(T)+RTInaB 正离子的化学势4=,(T)+RTIna 负离子的化学势4=°(T)+RTIna. 电解质的化学势为所有正、负离子的化学势之和,即 B=VL4+VL=(y,+y_°)+RTln(a·a) =g+RTln(a·a') 比较电解质化学势的表示式,有a3=a必
强电解质溶液的活度和活度系数 对任意价型电解质 + + M A M A + z z − − → + − B + = + + − − B B B ( ) ln o = + T RT a + + + ( ) ln ( ) ln o o T RT a T RT a − − − = + = + ( ) ln( ) o o RT a a + − = + + + + − − + − B ln( ) o RT a a + − = + + − 电解质的化学势 正离子的化学势 负离子的化学势 电解质的化学势为所有正、负离子的化学势之和,即 B a a a + − 比较电解质化学势的表示式,有 = + −

平均活度和平均活度系数 正负离子总是成对出现,单个离子的a4,不易直接测出。 定义离子平均活度(mean activity of ions) ader(ar-avw V-V+V 在电解质化学势的表示式中,用离子平均活度分 别替代正、负离子的活度系数,则可用离子平均活度 求出电解质的化学势: uB =vu +vu =v.(u+RTIna.)+v(u+RTIna) =v (u+RTIna.)+v(u+RTIna
正负离子总是成对出现,单个离子的a+(-) ,不易直接测出。 平均活度和平均活度系数 1 + def = a a a ( ) + + − − + − 定义离子平均活度(mean activity of ions) ( ln ) ( ln ) ( ln ) ( ln ) B o o o o RT RT a a R R T T a a + + − − + + − − + + − − − + = + = + + + = + + + 在电解质化学势的表示式中,用离子平均活度分 别替代正、负离子的活度系数,则可用离子平均活度 求出电解质的化学势:
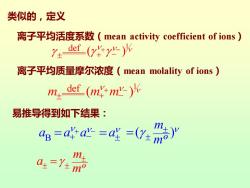
类似的,定义 离子平均活度系数(mean activity coefficient of ions) def( 离子平均质量摩尔浓度(mean molality of ions) m4dcf(mm)% 易推导得到如下结果: =aa心=ag=(0y:%》
类似的,定义 1 def ( ) + − + − 离子平均活度系数(mean activity coefficient of ions) 1 def m m m ( ) + − + − 离子平均质量摩尔浓度(mean molality of ions) o m a m = ( ) o m m = B a a a a + − + − = = 易推导得到如下结果:

例:写出CuS04,K2SO4与A2S04)3离子平均浓度与 电解质浓度的关系 CuSO mce =m,mso=m,V.=v =1,v=V,+v=2 m:=(m·m)=m NaSO,:myo =2m,msor=m,v,=2,v.=1,v=V+v=3 m=(mmt)=[(2m'm]=4.m 4,(S04)3:mo=2m,mo2=3m,V,=2,.=3,v=+业.=5 %=(mm)=[(2m-(3m)]=108.m
例:写出CuSO4,K2SO4与Al2 (SO4 )3离子平均浓度与 电解质浓度的关系 ( ) 2 2 4 4 + + 1 / : , , 1, 2 Cu SO CuSO m m m m m m m m + − + − + − − − = = = = = + = = = ( ) ( ) 2 4 2 4 + + 1 / 1/3 2 1/3 : 2 , , 2, 1, 3 2 4 Na SO Na SO m m m m m m m m m m + − + − + − − − = = = = = + = = = = ( ) ( ) ( ) ( ) 2 4 2 4 + + 3 1 / 1/5 2 3 1/5 : 2 , 3 , 2, 3, 5 2 3 108 Na SO Al SO m m m m m m m m m m + − + − + − − − = = = = = + = = = =

计算m=1.20 mol kg1的MgCL2水溶液在298K时的电解质活 度已知Y=0.630. 解:先求平均浓度与电解质浓度的关系 mus=m,mcr =2m,V.=1,v=2,v=v,+v=3 m=(m)=[m-(2m)2]=43.m a±=y±·m4/m°=0.630×43×1.20=1.20 aB=a=1.203=1.73
解:先求平均浓度与电解质浓度的关系 ( ) ( ) 2 + + 1 / 1/3 2 1/3 1/3 3 , 2 , 1, 2, 3 2 4 / 0.630 4 1.20 1.20 1.20 1.73 Mg Cl o B m m m m m m m m m m a m m a a + − + − + − − − = = = = = + = = = = = = = = = = 计算 m=1.20 mol kg-1的MgCl2水溶液在298K时的电解质活 度已知 0.630 . =
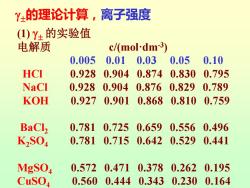
Y±的理论计算,离子强度 (1)Y±的实验值 电解质 c/(mol-dm-3) 0.005 0.01 0.03 0.05 0.10 HCI 0.928 0.9040.874 0.830 0.795 NaCl 0.928 0.904 0.876 0.829 0.789 KOH 0.927 0.9010.8680.810 0.759 BaCl2 0.7810.725 0.6590.556 0.496 K2S04 0.7810.7150.6420.5290.441 MgSO 0.572 0.4710.378 0.262 0.195 CuSO 0.5600.444 0.3430.2300.164
(1) 的实验值 电解质 c/(mol·dm-3 ) 0.005 0.01 0.03 0.05 0.10 HCl 0.928 0.904 0.874 0.830 0.795 NaCl 0.928 0.904 0.876 0.829 0.789 KOH 0.927 0.901 0.868 0.810 0.759 BaCl2 0.781 0.725 0.659 0.556 0.496 K2SO4 0.781 0.715 0.642 0.529 0.441 MgSO4 0.572 0.471 0.378 0.262 0.195 CuSO4 0.560 0.444 0.343 0.230 0.164 的理论计算,离子强度

离子强度 从实验结果看出,影响离子平均活度系数的主 要因素是电解质的总浓度和离子的价数,而价数的 影响更显著。 据此Lewis和Randall提出了离子强度(ionic strength)的概念。溶液的离子强度定义为离子浓 度与其价数的平方乘积总和的一半,写作 1=2∑mz 式中是溶液中离子的真实质量摩尔浓度,如果是 弱电解质则应由其相应的电离度求得;z是离子的价 数。离子强度的量纲与m相同
离子强度 2 i i i 1 2 I m z = 式中mi是溶液中i离子的真实质量摩尔浓度,如果是 弱电解质则应由其相应的电离度求得;zi是离子的价 数。离子强度I的量纲与m相同。 从实验结果看出,影响离子平均活度系数的主 要因素是电解质的总浓度和离子的价数,而价数的 影响更显著。 据此Lewis和Randall提出了离子强度(ionic strength)的概念。溶液的离子强度I定义为离子浓 度与其价数的平方乘积总和的一半,写作 I
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(2/3)电导(Electric Conductance).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十章 电解质溶液理论(1/3)电化学(Electrochemistry)绪论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(2/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第九章 几种特征反应动力学(1/2).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(6/6)分子反应动态学(molecular reaction dynamics).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(5/6)单分子反应理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(4/6)原盐效应.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(3/6)过渡态理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(2/6)碰撞理论在溶液反应中的应用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第八章 反应速率理论(1/6)碰撞理论.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(传递现象 Transport Phenomenon).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(链反应及复杂反应动力学近似处理).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(几种典型的复杂反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(温度对反应速率的影响).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应的速率方程、积分速率方程-具有简单级数的反应).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学反应速率).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第七章 宏观反应动力学(化学动力学的任务和目的).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(化学反应平衡常数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(物质的热容理论、理想气体化学势).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学(分子配分函数).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §6 溶胶的稳定性和聚沉作用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §1 可逆电池和不可逆电池.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §2 可逆电池的热力学.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §3 电动势产生的机理.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §4 平衡电极电势和电池电动势 §5 可逆电极的种类.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §6 可逆电池电动势的计算 §7 电动势的测量.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十一章 可逆电池电动势及其应用 §8 电动势测定的应用.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十二章 不可逆电极过程 §1 不可逆电极过程中的电极极化.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十二章 不可逆电极过程 §2 电解时的电极反应.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十二章 不可逆电极过程 §3 金属的电化学腐蚀和保护.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十二章 不可逆电极过程 §4 化学电源.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(1/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(3/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(4/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(5/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(6/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(7/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §2 溶胶的制备与净化.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §3 溶胶的动力性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §4 溶胶的光学性质.ppt
