《物理化学》课程教学课件(PPT讲稿)§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程
第十一章微分法积分法半衰期法孤立法化学动力学基础一)一级反应平行反应连续反应对峙反应链反应
第十一章 积分法 微分法 半衰期法 孤立法 一级反应 对峙反应 平行反应 连续反应 链反应

目录S 11.1化学动力学的任务和目的S 11.2 化学反应速率的表示法S 11.3 化学反应的速率方程S11.4具有简单级数的反应S11.5几种典型的复杂反应*S11.6基元反应的微观可逆性原理S11.7温度对反应速率的影响* s 11.8 关于活化能S 11.9链反应*S11.10 拟定反应历程的一般方法
§11.1 化学动力学的任务和目的 目录 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程 §11.4 具有简单级数的反应 §11.5 几种典型的复杂反应 *§11.6 基元反应的微观可逆性原理 §11.7 温度对反应速率的影响 *§11.8 关于活化能 §11.9 链反应 *§11.10 拟定反应历程的一般方法

s 11.1化学动力学的任务和目的化学热力学的研究对象与局限性化学热力学主要研究化学反应进行的方向、限度和外界因素对平衡的影响。即在给定条件下反应能不能发生,以及反应进行的程度如何。化学热力学只能预测反应的可能性,但无法预料反应速率和反应机理
化学热力学的研究对象与局限性 化学热力学主要研究化学反应进行的方向、限度 和外界因素对平衡的影响。即在给定条件下反应能 不能发生,以及反应进行的程度如何。 化学热力学只能预测反应的可能性,但无法预料 反应速率和反应机理。 §11.1 化学动力学的任务和目的

s 11.1化学动力学的任务和目的化学热力学的研究对象与局限性△,Gs / kJ·mol-l3H(g)N→NH,(g)(g)+-16.632-237.19=0,(g)→H,0 (1)(2) H, (g) +2热力学只能判断这两个反应均可以进行,但如何使之发生,热力学却无法回答。而在指定条件下,这两个反应在动力学上是不利的,反应速率很慢。改变外界条件(高温、加入催化剂等),则可以增大反应速率。4,Gm= - 79.91 kJ.mol-1HCl(ag)+NaOH(ag)→>NaCl(ag)+H,O反应瞬间即可完成
热力学只能判断这两个反应均可以进行,但如何使之发生, 热力学却无法回答。而在指定条件下,这两个反应在动力学上 是不利的,反应速率很慢。改变外界条件(高温、加入催化剂 等),则可以增大反应速率。 2 2 3 2 2 2 1 3 (1) N (g) H (g) NH (g) 2 2 1 (2) H (g) O (g) H O (l) 2 + ⎯⎯→ + ⎯⎯→ 1 r m / kJ mol 16.63 237.19 G − − − $ §11.1 化学动力学的任务和目的 HCl(aq)+NaOH(aq)→NaCl(aq)+H2O rGm y= – 79.91 kJ.mol-1 反应瞬间即可完成。 化学热力学的研究对象与局限性

s 11.1化学动力学的任务和目的化学动力学的任务与目的研究反应速率;》讨论各种因素(浓度、压力、温度、介质、催化剂等)对反应速率的影响:研究反应机理,讨论反应中的决速步等;》目的使热力学的反应可能性变为现实性-, +=H2 →NH,(g)N.需一定的T,p和催化剂22加温或催化剂H, +=02 →H,0(1)2
➢ 研究反应速率; ➢ 讨论各种因素(浓度、压力、温度、介质 、 催化剂等)对反应速率的影响; ➢ 研究反应机理,讨论反应中的决速步等; ➢ 目的使热力学的反应可能性变为现实性。 化学动力学的任务与目的 2 2 3 2 2 2 1 3 N H NH (g) 2 2 1 H O H O(l) 2 + → + → 需一定的T、p和催化剂 加温或催化剂 §11.1 化学动力学的任务和目的

s 11. 1化学动力学的任务和目的化学动力学发展概况大致分为三个发展阶段:>研宏观反应动力学阶段(19世纪后半叶至20世纪初)研究总包反应,研究外界因素对反应速率的影响。>元反应动力学阶段(20世纪初至20世纪50年代)尝试从理论上研究反应动力学规律。>微观反应动力学阶段(20世纪50年代以后)研究快速反应动力学、分子反应动态学
化学动力学发展概况 ◆ 大致分为三个发展阶段: ➢研宏观反应动力学阶段(19世纪后半叶至20世纪初) 研究总包反应,研究外界因素对反应速率的影响。 ➢ 元反应动力学阶段(20世纪初至20世纪50年代) 尝试从理论上研究反应动力学规律。 ➢ 微观反应动力学阶段(20世纪50年代以后) 研究快速反应动力学、分子反应动态学。 §11.1 化学动力学的任务和目的

s 11. 1化学动力学的任务和目的化学动力学发展概况十九世纪中:威廉米提出浓度与反应速率的关系;古德尔格等提出了质量作用定律。十九世纪末:范霍夫、阿仑尼乌斯的反应速率与温度的关系、反应活化能的概念。二十世纪:化学动力学、催化等有了新发展。提出了碰撞理论和过渡态理论,建立了势能面。发现了链反应,从总包反应向基元反应过渡。特别是许多新技术,例如:激光技术、交叉分子束、计算机等用于动力学的研究;闪光光解技术用于研究快速反应动力学;飞秒激光器用于研究态-态反应动力学,可以观测化学键在原子尺度上的振动
十九世纪中:威廉米提出浓度与反应速率的关系;古德尔格 等提出了质量作用定律。 十九世纪末:范霍夫、阿仑尼乌斯的反应速率与温度的关系、 反应活化能的概念。 二十世纪:化学动力学、催化等有了新发展。提出了碰撞理 论和过渡态理论,建立了势能面。发现了链反应,从总包反 应向基元反应过渡。特别是许多新技术,例如:激光技术、 交叉分子束、计算机等用于动力学的研究;闪光光解技术用 于研究快速反应动力学;飞秒激光器用于研究态-态反应动 力学,可以观测化学键在原子尺度上的振动。 化学动力学发展概况 §11.1 化学动力学的任务和目的

s 11.1化学动力学的任务和目的化学动力学发展概况·近百年来,由于实验方法和检测手段的日新月异如磁共振技术、闪光光解技术等,使化学动力学发展极快10-3s1950年左右,测时间分辨率小于10-°s1970年左右,测时间分辨率到了10-12 s1980年左右,测时间分辨率到了10-15 s2000年左右,测时间分辨率到了·动力学理论尚不够完善,还需继续努力
•近百年来,由于实验方法和检测手段的日新月异, 如磁共振技术、闪光光解技术等,使化学动力学发 展极快 1950年左右,测时间分辨率小于 •动力学理论尚不够完善,还需继续努力 3 10 s − 1970年左右,测时间分辨率到了 6 10 s − 1980年左右,测时间分辨率到了 12 10 s − 2000年左右,测时间分辨率到了 15 10 s − §11.1 化学动力学的任务和目的 化学动力学发展概况
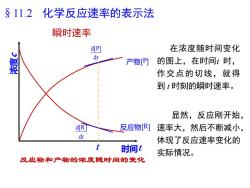
$ 11.2化学反应速率的表示法瞬时速率在浓度随时间变化d[P]dt的图上,在时间t时,产物[P]作交点的切线,就得到t时刻的瞬时速率。显然,反应刚开始,d[R]反应物[R]速率大,然后不断减小,dt体现了反应速率变化的t时间t实际情况。反应物和产物的浓度随时间的变化
瞬时速率 浓度 c 时间 t 反应物[R] d[P] dt d[R] dt 反应物和产物的浓度随时间的变化 产物[P] t §11.2 化学反应速率的表示法 在浓度随时间变化 的图上,在时间t 时, 作交点的切线,就得 到 t 时刻的瞬时速率。 显然,反应刚开始, 速率大,然后不断减小, 体现了反应速率变化的 实际情况

$ 11.2化学反应速率的表示法速度是量,有方向性。velocity速率是标量,无方向性,都是正值。rate例如:R-P>d[P]d[R]速度0dtdtd[R]d[P]速率dtdt
§11.2 化学反应速率的表示法 速度 velocity 是矢量,有方向性。 速率 rate 是标量 ,无方向性,都是正值。 d[R] d[P] 0 0 d d t t 速度 d[R] d[P] 0 d d t t 速率 − = 例如: R P ⎯⎯→
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)§11.4 具有简单级数的反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.5 几种典型的复杂反应 §11.7 温度对反应速率的影响.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.8 关于活化能 §11.9 链反应 §11.10 拟定反应历程的一般方法.ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一)习题课.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(12.1-12.7).ppt
- 《物理化学》课程教学课件(PPT讲稿)12.9 复习题 催化反应动力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)13章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)14章 胶体与大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 统计热力学基础计.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电解质浴液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十章 电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十一章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十二章 化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十三章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十四章 胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学(习题课).ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)13章 表面物理化学-习题课.ppt
- 《物理化学》课程教学资源(导学任务)第1次课.doc
- 《物理化学》课程教学课件(PPT讲稿)10.5 化学电源.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.4 金属的电化学腐蚀、防腐与金属的钝化.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§10.1 分解电压 §10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)9.7 电动势测定的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.5 电动势产生的机理 §9.6 电极电势和电池的电动势.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.1 可逆电池和可逆电极 §9.2 电动势的测定.ppt
- 《物理化学》课程教学课件(PPT讲稿)B08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.3 电解质溶液的电导.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《分析化学》课程教学资源(课件讲稿)7-重量分析法.pdf
- 《分析化学》课程教学资源(课件讲稿)6-沉淀滴定法和滴定分析小结.pdf
- 《分析化学》课程教学资源(课件讲稿)5-氧化还原滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)4-配位滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)3-酸碱滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)2-误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)1-概论.pdf
