《分析化学》课程教学资源(课件讲稿)6-沉淀滴定法和滴定分析小结

第8章沉淀滴定法和滴定分析小结沉淀滴定法8.1滴定分析小结8.2
1 第8章 沉淀滴定法和滴定分析小结 8.1 沉淀滴定法 8.2 滴定分析小结

8.1沉淀滴定法滴定原理:用沉淀反应来进行滴定分析的方法滴定条件:沉淀有固定的组成,反应物之间有准确的计量关系沉淀溶解度小,反应完全沉淀吸附杂质少>反应速度快,有合适的指示终点的方法:分析方法----银量法:>莫尔法>佛尔哈德法>法扬司法山东理工大学2SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 2 沉淀滴定法 • 滴定原理: 用沉淀反应来进行滴定分析的方法 • 滴定条件: 沉淀有固定的组成,反应物之间有准确的计量关系 沉淀溶解度小,反应完全 沉淀吸附杂质少 反应速度快,有合适的指示终点的方法 • 分析方法-银量法: 莫尔法 佛尔哈德法 法扬司法

8.1.1滴定曲线0.1000mol·L-1AgNO,滴定20.00mL0.1000mol·L-1NaCIl溶液Ag+ + CI = AgCllKsp= [Ag*I[CI]=1.8 × 10-10pAg+pCI=pKspK=(Ksp)-1= (1.8 X 10-10 )-1 = 5.6 X 109滴定开始前:[CI] = 0.1000 mol/L, pCI =-lg[CIF]= 1.00山东理工大3HANDONGUNIVERSITYOFTECHNOLOGAnalytical Chemistry
Analytical Chemistry 3 滴定曲线 Ag+ + Cl- = AgCl↓ Ksp= [Ag+ ][Cl- ]=1.8×10-10 pAg+pCl=pKsp K=(Ksp) -1= (1.8×10-10 ) -1 = 5.6×109 0.1000 mol·L-1 AgNO3滴定20.00 mL 0.1000mol·L-1NaCl 溶液 滴定开始前: [Cl- ] = 0.1000 mol/L, pCl =-lg[Cl- ]= 1.00

CI-剩余化学计量点sp前:CclVc -CAgVAg[CI-]=Vc +VAg当加入19.98mLAgNO,溶液,sp前0.1% :0.1000x20.00-0.1000x19.98= 5.0×10-5[CI-] :20.00+19.98pCI=-lg[CI]=4.30山东理工大4SHANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 4 化学计量点sp前: Cl-剩余 Cl Ag Cl Cl Ag Ag V V c V c V [Cl ] sp前0.1% : pCl=-lg[Cl- ]=4.30 -5 5.0 10 20.00 19.98 0.1000 20.00 0.1000 19.98 [Cl ] 当加入19.98 mL AgNO3溶液

化学计量点sp:[Ag]-[C][Ag*][CI-]= K[CI']=[Ag*]= K, =1.3×10-5pCl = pAg = 4.89:Agt过量化学计量点sp后:CAgVAg - CcVclK[Ag]=CVe,+VAg[Ag↑]当加入20.02mLAgNO溶液sp后0.1%K0.02=3.6×10-65.0×10-5[CI-][Ag*]=0.1 ×[Ag↑]40.02pCI=5.44山东理工大5HANDONGUNIVERSITYOETECHNOLOGAnalyticalChemistry
Analytical Chemistry 5 化学计量点sp:[Ag+ ]=[Cl- ] 5 sp [Cl ]=[Ag ] 1.3 10 pCl pAg 4.89 K sp [Ag ][Cl ] K 化学计量点sp后:Ag+过量 [Ag ] Ag Ag Cl Cl Cl Ag c V c V V V [Ag ] [Cl ] Ksp 0.02 5 [Ag ] 0.1 5.0 10 40.02 pCl=5.44 sp后0.1% sp 6 [Cl ] 3.6 10 [Ag ] K 当加入20.02 mL AgNO3溶液
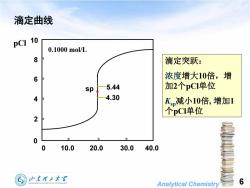
滴定曲线10pCI0.1000 mol/L8滴定突跃:浓度增大10倍,增6加2个pCI单位5.44sp4.304K,减小10倍,增加1个pCI单位20010.020.030.040.0山东理工大学6SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 6 滴定曲线 0 10.0 20.0 30.0 40.0 pCl 0.1000 mol/L 5.44 4.30 0 2 4 6 8 10 sp 滴定突跃: 浓度增大10倍,增 加2个pCl单位 Ksp减小10倍, 增加1 个pCl单位

8.1.2沉淀滴定终点指示剂和沉淀滴定法Ag+ + X-= AgX 银量法(X-为CI、Br、I和SCN-等)莫尔(Mohr)法指示终点方式佛尔哈德(Volhard)法法扬司(Fajans)法山东理工大7SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 7 沉淀滴定终点指示剂和沉淀滴定法 Ag+ + X- = AgX↓ (X-为Cl-、Br-、I -和SCN-等) 银量法 莫尔(Mohr)法 佛尔哈德(Volhard)法 法扬司(Fajans)法 指示终点方式

一、莫尔法1、直接滴定法滴定反应:Ag+ + X-AgX 1滴定剂:AgNO.标准溶液待测物:CI、Br指示剂:K,CrO4(1) 测定原理滴定反应:: Ag++CI=AgCII(白色)Ksp (AgCI) = 1.8 X 10-10终点反应:2Ag++CrO2-=Ag,CrO41(砖红色)Ksp (Ag,CrO4) = 2.0 X 10-12山东翟工大学8SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 8 滴定反应: Ag+ + Cl- = AgCl↓(白色) Ksp (AgCl) = 1.8×10-10 终点反应: 2Ag+ + CrO4 2-= Ag2CrO4 ↓(砖红色) Ksp (Ag2CrO4 ) = 2.0×10-12 一、莫尔法 指示剂:K2CrO4 滴定反应:Ag+ + X- AgX 滴定剂:AgNO3 标准溶液 待测物:Cl-、Br- (1) 测定原理 1、直接滴定法

(2) 滴定条件1.指示剂的用量化学计量点时:[Ag*],=[CI],=/,(AgCI)=V1.8×10-1°=1.3×10-5形成Ag,CrO4所需的最低的[CrO.2-]:[Ag* },[CrO2 ]sp = K,p(Ag,CrO4)2.0×10-12Ksp(Ag2CrO4)= 1.2 ×10-2则 [CrO]sp=(1.3×105)2[AgP?K,CrO,浓度CrO.2-太大,终点提前理论值1.2 X 10-2 mol·L-1CrO2-太小,终点滞后实验值5.0×10-3 mol·L-1为宜山东理工大字9ANDONGUNIVERSITYOFTECHNOLCAnalytical Chemistry
Analytical Chemistry 9 (2) 滴定条件 - -10 -5 sp [Ag ] [Cl ] (AgCl) 1.8 10 1.3 10 sp sp K [Ag ] [CrO ] (Ag CrO ) sp 2 4 2- 4 2 sp sp K -12 2- -2 sp 2 4 4 sp 2 -5 2 (Ag CrO ) 2.0 10 [CrO ] 1.2 10 [Ag ] (1.3 10 ) K 则 形成Ag2CrO4所需的最低的[CrO4 2- ]: 1. 指示剂的用量 化学计量点时: K2CrO4浓度 理论值 1.2×10-2 mol·L-1 实验值 5.0×10-3 mol·L-1为宜 CrO4 2-太大,终点提前 CrO4 2-太小,终点滞后

2.溶液的酸度适宜的酸度为中性或弱碱性(pH=6.5~10.0)pH 6.5H++Cr042- Cr,0,2- (K=4.3 X1014)酸性过强,导致[CrO2-1降低,终点滞后pH>10.0时Ag* +OH →AgOH→ Ag,O pH< 10.0碱性太强,Ag,O沉淀,终点拖后山东理工大字10ANDONGUNIVERSITYOFTECHNOLOGAnalytical Chemistry
Analytical Chemistry 10 2. 溶液的酸度 适宜的酸度为中性或弱碱性(pH=6.5~10.0), H++CrO4 2- Cr2O7 2- (K=4.3×1014) 碱性太强, Ag2O 沉淀,终点拖后 pH> 6.5 酸性过强,导致[CrO4 2- ]降低,终点滞后 pH< 10.0 Ag OH AgOH Ag2 O pH<6.5时 pH>10.0时
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(课件讲稿)7-重量分析法.pdf
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.3 电解质溶液的电导.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数.ppt
- 《物理化学》课程教学课件(PPT讲稿)B08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.1 可逆电池和可逆电极 §9.2 电动势的测定.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.5 电动势产生的机理 §9.6 电极电势和电池的电动势.ppt
- 《物理化学》课程教学课件(PPT讲稿)9.7 电动势测定的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)§10.1 分解电压 §10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.4 金属的电化学腐蚀、防腐与金属的钝化.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.5 化学电源.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.4 具有简单级数的反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.5 几种典型的复杂反应 §11.7 温度对反应速率的影响.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.8 关于活化能 §11.9 链反应 §11.10 拟定反应历程的一般方法.ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一)习题课.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(12.1-12.7).ppt
- 《分析化学》课程教学资源(课件讲稿)5-氧化还原滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)4-配位滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)3-酸碱滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)2-误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)1-概论.pdf
- 《物理化学》课程教学课件(PPT讲稿)胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第10章 电解与极化作用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学辅导与习题详解(共十四章).pdf
