《物理化学》课程教学课件(PPT讲稿)电解与极化作用
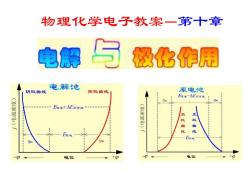
物理化学电子教案-第十章 电解与极化作用 电解池 阴极曲线 阳极曲线 原电池 E可逆-△E不可 77m 17 (海香) E可+△E不可 (海) 负极曲线 正极曲线 E可逆 E可 7m 170 -4 电位 +φ —4 电位 +4
物理化学电子教案—第十章

第十章电解与极化作用s 10.1 分解电压S10.2极化作用S10.3电解时电极上的竞争反应S10.4金属的电化学腐蚀、防腐与金属的钝化S10.5化学电源
第十章 电解与极化作用 §10.1 分解电压 §10.3 电解时电极上的竞争反应 §10.2 极化作用 §10.4 金属的电化学腐蚀、防腐与金属的钝化 §10.5 化学电源

s 10.1理论分解电压1.理论分解电压2.分解电压的测定3.实际分解电压
§10.1 理论分解电压 1. 理论分解电压 3. 实际分解电压 2. 分解电压的测定

使某电解质溶液能连续不断发1.理论分解电压生电解时所必须外加的最小电压,在数值上等于该电解池作为可逆电池时的可逆电动势E(理论分解)=E(可逆)
1.理论分解电压 使某电解质溶液能连续不断发 生电解时所必须外加的最小电压,在数值上等于该 电解池作为可逆电池时的可逆电动势 E E ( ) ( ) 理论分解 可逆 =
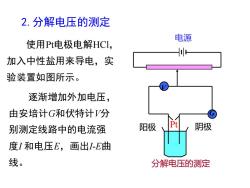
2.分解电压的测定电源使用Pt电极电解HClo加入中性盐用来导电,实验装置如图所示。逐渐增加外加电压,由安培计G和伏特计V分GPt阴极阳极别测定线路中的电流强度I和电压E,画出I-E曲线。分解电压的测定
2.分解电压的测定 使用Pt电极电解HCl, 加入中性盐用来导电,实 验装置如图所示。 逐渐增加外加电压, 由安培计G和伏特计V分 别测定线路中的电流强 度I 和电压E,画出I-E曲 线。 电源 分解电压的测定 阳极 Pt 阴极 V G
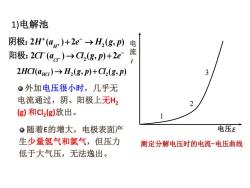
1)电解池阴极: 2H+(au+)+2e→H,(g,p)电流阳极: 2C(a)→Cl,(g, p)+ 2e-12HCl(aμc) → H,(g, p) +Cl,(g, p)3·外加电压很小时,几乎无电流通过,阴、阳极上无H2(g)和Cl,(g)放出。电压E。随着E的增大,电极表面产生少量氢气和氯气,但压力测定分解电压时的电流一电压曲线低于大气压,无法逸出
外加电压很小时,几乎无 电流通过,阴、阳极上无H2 (g) 和Cl2 (g)放出。 随着E的增大,电极表面产 生少量氢气和氯气,但压力 低于大气压,无法逸出。 电 流 I 电压E 1 2 3 测定分解电压时的电流-电压曲线 2 2 ( ) 2 ( , ) H H a e H g p + + − 阴极: + →2 2 ( ) ( , ) 2 Cl Cl a Cl g p e − 阳极: − − → + 2 2 2 ( ) ( , ) ( , ) HCl a H g p Cl g p HCl → + 1)电解池
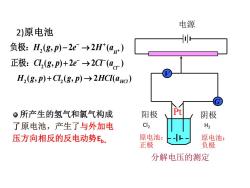
电源2)原电池o负极: H,(g,P)-2e- →2H*(ag+正极: Cl,(g,p)+2e- →2Cl(a)H,(g, p)+Cl,(g, P) →2HCl(ac)Pt阳极。所产生的氢气和氯气构成阴极Cl2H2了原电池,产生了与外加电原电池:-F原电池:压方向相反的反电动势E,正极负极分解电压的测定
电源 分解电压的测定 阳极 Pt 阴极 V G 所产生的氢气和氯气构成 了原电池,产生了与外加电 压方向相反的反电动势Eb。 2 ( , ) 2 2 ( ) H H g p e H a + − + 负极: − → 2 ( , ) 2 2 ( ) Cl Cl g p e Cl a − − − 正极: + → 2)原电池 2 2 ( , ) ( , ) 2 ( ) H g p Cl g p HCl aHCl + → Cl2 H2 原电池: 正极 原电池: 负极
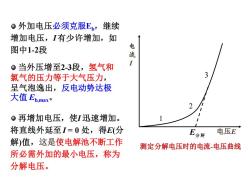
。外加电压必须克服E,继续增加电压,I有少许增加,如电图中1-2段流1。当外压增至2-3段,氢气和3氯气的压力等于大气压力呈气泡逸出,反电动势达极大值Eb,maxo。再增加电压,使I迅速增加。1将直线外延至I=0处,得E(分电压EE分饼解值,这是使电解池不断工作测定分解电压时的电流-电压曲线所必需外加的最小电压,称为分解电压
当外压增至2-3段,氢气和 氯气的压力等于大气压力, 呈气泡逸出,反电动势达极 大值 Eb,max。 再增加电压,使I 迅速增加。 将直线外延至I = 0 处,得E(分 解)值,这是使电解池不断工作 所必需外加的最小电压,称为 分解电压。 E I 电压E 1 2 3 测定分解电压时的电流-电压曲线 外加电压必须克服Eb,继续 增加电压,I 有少许增加,如 图中1-2段
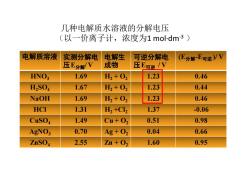
几种电解质水溶液的分解电压(以一价离子计,浓度为1moldm-3)电解质溶液电解生可逆分解电(E分解-E可逆)/V实测分解电压E分解/V成物压E可逆/V1.691.230.46HNO3H+021.671.230.44H, + 02H,SO1.23NaOH1.69H+020.46HCI1.311.37-0.06H,+Cl21.490.51Cu+ 020.98CuSO40.700.040.66AgNO3Ag+022.550.95ZnSO4Zn + O21.60
几种电解质水溶液的分解电压 (以一价离子计,浓度为1 mol·dm-3 ) 电解质溶液 实测分解电 压E分解/ V 电解生 成物 可逆分解电 压E可逆 / V (E分解-E可逆 )/ V HNO3 1.69 H2 + O2 1.23 0.46 H2SO4 1.67 H2 + O2 1.23 0.44 NaOH 1.69 H2 + O2 1.23 0.46 HCl 1.31 H2 +Cl2 1.37 -0.06 CuSO4 1.49 Cu + O2 0.51 0.98 AgNO3 0.70 Ag + O2 0.04 0.66 ZnSO4 2.55 Zn + O2 1.60 0.95

3.实际分解电压要使电解池顺利地进行连续反应,除了克服作为原电池时的可逆电动势外,还要克服由于极化在阴、阳极上产生的超电势n(阴)和n(阳),以及克服电池电阻所产生的电位降IR。这三者的加和就称为实际分解电压。E(分解)= E(可逆)+△E(不可逆)+IR△E(不可逆)=n(阳)+n(阴)显然分解电压的数值会随着通入电流强度的增加而增加
E E E IR ( ) ( ) ( ) 分解 可逆 不可逆 = + + 要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势 和 ,以及克服电 池电阻所产生的电位降 。这三者的加和就称为实 际分解电压。 ( ) 阴 ( ) 阳 IR 显然分解电压的数值会随着通入电流强度的增加而 增加。 3.实际分解电压 = + E( ) ( ) ( ) 不可逆 阳 阴
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)胶体分散系统和大分子溶液.ppt
- 《分析化学》课程教学资源(课件讲稿)1-概论.pdf
- 《分析化学》课程教学资源(课件讲稿)2-误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)3-酸碱滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)4-配位滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)5-氧化还原滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)6-沉淀滴定法和滴定分析小结.pdf
- 《分析化学》课程教学资源(课件讲稿)7-重量分析法.pdf
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.3 电解质溶液的电导.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数.ppt
- 《物理化学》课程教学课件(PPT讲稿)B08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.1 可逆电池和可逆电极 §9.2 电动势的测定.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.5 电动势产生的机理 §9.6 电极电势和电池的电动势.ppt
- 《物理化学》课程教学课件(PPT讲稿)可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第10章 电解与极化作用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学辅导与习题详解(共十四章).pdf
- 《物理化学》课程教学课件(PPT讲稿)A08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十三章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十二章 化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十一章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十章 电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程各章习题(含参考答案)第十四章 胶体分散系统和大分子溶液.pdf
- 《物理化学》课程各章习题(含参考答案)第十三章 表面物理化学.pdf
- 《物理化学》课程各章习题(含参考答案)第十二章 化学动力学基础(二).pdf
- 《物理化学》课程各章习题(含参考答案)第十一章 化学动力学基础(一).pdf
- 《物理化学》课程各章习题(含参考答案)第十章 电极极化.pdf
