《分析化学》课程教学资源(课件讲稿)3-酸碱滴定法

第5章酸碱滴定法溶液中的酸碱反应与平衡5.15.2酸碱组分平衡浓度与分布分数溶液中的H+浓度计算5.35.5酸碱缓冲溶液酸碱指示剂5.65.7酸碱滴定原理酸碱滴定法的应用5.9
1 5.1 溶液中的酸碱反应与平衡 5.2 酸碱组分平衡浓度与分布分数 5.3 溶液中的H+浓度计算 5.5 酸碱缓冲溶液 5.6 酸碱指示剂 5.7 酸碱滴定原理 5.9 酸碱滴定法的应用 第5章 酸碱滴定法

不做考试大纲要求的内容课本5.3.3混合溶液5.4对数图解法5.7.3多元酸和混合酸的滴定5.8终点误差5.10非水溶液中的酸碱滴定智慧树在线课(知到app)3.9多元弱酸碱和混合酸碱pH的计算(弱)「酸碱3.17~3.18终点误差计算一一元强山东理工大2HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 5.3.3 混合溶液 5.4 对数图解法 5.7.3 多元酸和混合酸的滴定 5.8 终点误差 5.10 非水溶液中的酸碱滴定 2 不做考试大纲要求的内容 课本 智慧树在线课(知到app) 3.9 多元弱酸碱和混合酸碱pH的计算 3.17~3.18 终点误差计算——一元强(弱)酸碱

5.1溶液中的酸碱反应与平衡5.1.2溶液中的酸碱反应与平衡常数质子酸碱理论(Brosted-Lowry theory, 1923)HAC,NH4酸:凡是能给出质子的物质(质子给予体)碱:凡是能接受质子的物质(质子接受体)Ac、NH3两性物质:既能接受质子也能给出质子的物质酸式酸根离子、弱酸弱碱盐、两性溶剂、氨基酸类山东理工大3SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 3 质子酸碱理论(Brösted-Lowry theory,1923) 溶液中的酸碱反应与平衡常数 酸:凡是能给出质子的物质(质子给予体) 碱:凡是能接受质子的物质(质子接受体) 两性物质:既能接受质子也能给出质子的物质 HAc、 NH4 + Ac-、 NH3 酸式酸根离子、弱酸 弱碱盐、两性溶剂、 氨基酸类 溶液中的酸碱反应与平衡

酸碱反应的实质1、共轭酸碱对:因一个质子的得失而相互转化的一对酸碱如:HAc-AcHAc =Ac-+H+NH, +H+= NH4NH4+-NH3HSO4 =H++ SO.2- →HSO: - SO.?例下列各组酸碱组分中,属于共轭酸碱对的是(1) H,0+-0H(2)H,0+-H,0(3)HPO 2--PO.3(4)NH,+CH,COOH -NH,CH,COO(5) H,SO4-SO.2山东理工大学4HANDONGUNIVERSITYOETECHNOLOGAnalyticalChemistry
Analytical Chemistry 4 1、共轭酸碱对:因一个质子的得失而相互转化的一对酸碱。 如: HAc = Ac- + H+ → HAc-Ac- NH3 + H+ = NH4 + → NH4 + -NH3 HSO4 - = H+ + SO4 2- → HSO4 - - SO4 2- 一、酸碱反应的实质 例 下列各组酸碱组分中,属于共轭酸碱对的是 (1)H3O+-OH- (2)H3O+-H2O (3)HPO4 2--PO4 3- (4)NH3 +CH2COOH -NH2CH2COO- (5)H2SO4-SO4 2-

共轭酸碱对特点:1.共轭酸碱对是仅相差一个质子的一对物质2.酸碱可以是中性分子、阴离子或阳离子H+的共轭碱是什么?3.酸碱的含义具有相对性:H,O是酸还是碱?①同一物质在不同的共轭酸碱对中,可表现出不同的酸碱性。②溶剂不同时,同一物质表现出不同的酸碱性。共轭酸碱对相互转化的反应。2、酸碱半反应:共轭酸+ H+二共轭碱conjugate acidprotonconjugate base山东理工大5HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 5 共轭酸碱对特点: 1. 共轭酸碱对是仅相差一个质子的一对物质; 2. 酸碱可以是中性分子、阴离子或阳离子; 3. 酸碱的含义具有相对性: ① 同一物质在不同的共轭酸碱对中,可表现出不同的酸碱性。 ② 溶剂不同时,同一物质表现出不同的酸碱性。 H+ 的共轭碱是什么? H2O是酸还是碱? 共轭酸 共轭碱 + H+ conjugate acid conjugate base proton 2、酸碱半反应:共轭酸碱对相互转化的反应

3、酸碱反应由两个酸碱半反应构成例:HAc与NH,水中的反应半反应:+H+HAc -Ac-半反应:NH4+H++ NH H+总反应:HAc + NH,NH.Ac酸碱反应的实质一一酉酸碱间的质子授受过程质子的转移山东理工大字6SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 6 3、酸碱反应 酸碱反应的实质——酸碱间的质子授受过程 质子的转移 ——由两个酸碱半反应构成 总反应: HAc + NH3 NH4Ac H+ 半反应: H+ + NH3 NH4 + 半反应: HAc Ac- + H+ 例: HAc与NH3 水中的反应

酸碱反应类型与平衡常数1、溶剂分子之间的质子转移反应一质子自递反应H,O=H++OHH,O+H,0=H,0++OHK, =[H,O*J[OH ]=[H[OH ]=1×10-14SH+SH =SH,+SK, =[SH, ][S-]K一溶剂分子的质子自递常数山东翟工大学7HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 7 H2 O H2 O H3 O OH 1、溶剂分子之间的质子转移反应—质子自递反应 [SH ][S ] SH SH SH S 2 2 Ks K—溶剂分子的质子自递常数 1 4 [H3 O ][OH ] [H ][OH ] 1 10 Kw H2 O H OH 二、酸碱反应类型与平衡常数

2、酸碱溶质与溶剂分子间的反应一酸碱的解离HAc=Ac-+HtHAc+H,O=Ac- +H,OK.=[Ac-1H+]/HAcK,=[Ac-][H,O+]/[HAc]K一酸的解离常数NH+H,O=NH +OHK一碱的解离常数K, =[NH][OH]/[NH,]酸碱的强弱取决于给出质子或接受质子的能力通常用解离常数的大小衡量。K,或(K,或K)K,越大,酸碱强度越强。山东翟工大8HANDONGUNIVERSITYOFTECHNOLOGAnalytical Chemistry
Analytical Chemistry 8 2、酸碱溶质与溶剂分子间的反应—酸碱的解离 [Ac ][H O ]/[HAc] HAc H O Ac H O 3 2 3 Ka [Ac ][H ]/[HAc] HAc Ac H Ka Ka—酸的解离常数 Kb—碱的解离常数 [NH ][OH ]/[NH ] NH H O NH OH 4 3 3 2 4 Kb 酸碱的强弱取决于给出质子或接受质子的能力, 通常用解离常数(Ka 或 Kb)的大小衡量。 Ka 或 Kb越大,酸碱强度越强
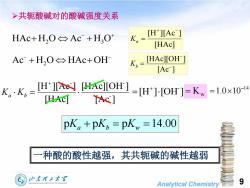
>共轭酸碱对的酸碱强度关系[H][AcHAc+H,O←Ac +H,OK[HAc][HAc][OH-Ac+H,O←HAc+OHKh[Ac][H+][A][HAc][OH]=1.0×10-14KK,:=[H+]·[OH] = K,一[Ac][HAc]pK. +pK, =pKw =14.00种酸的酸性越强,其共轭碱的碱性越弱山东翟工大学9SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 9 共轭酸碱对的酸碱强度关系 HAc H2 O Ac H3 O [HAc] [H ][Ac ] Ka Ac H2 O HAcOH [Ac ] [HAc][OH ] Kb [Ac ] [HAc][OH ] [HAc] [H ][Ac ] - - - Ka Kb [H ] [OH ] - Kw 14 1.0 10 pKa pKb pKw 14.00 一种酸的酸性越强,其共轭碱的碱性越弱
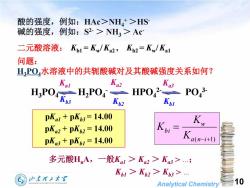
酸的强度,例如:HAc>NH+>HS碱的强度,例如:S2-> NH,>Ac二元酸溶液:Kb1= Kw/ Ka2,Kb2= Kw/ Kal问题:水溶液中的共轭酸碱对及其酸碱强度关系如何?H,POKa2Ka3KalPO,3-2HPO4H,POH,PO4Kb3Kp2KblpKal + pKb3 = 14.00KWKbipKa2 + pKb2=14.00Ka(n-i+1)pKa3 + pKb1 = 14.00多元酸H,A,一般Ka >Ka2 >Ka3>.…;Kbl > K2 > Kb3 >.山东理工大10HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 10 酸的强度,例如:HAc>NH4 + >HS- 碱的强度,例如:S 2- > NH3 > Ac- 问题: H3PO4水溶液中的共轭酸碱对及其酸碱强度关系如何? H3PO4 H2PO4 - HPO4 2- PO4 3- Kb2 Kb1 Kb3 Ka1 Ka2 Ka3 pKa1 + pKb3 = 14.00 pKa2 + pKb2 = 14.00 pKa3 + pKb1 = 14.00 ( 1) a n i w b i K K K 多元酸HnA,一般Ka1 > Ka2 > Ka3 > .; Kb1 > Kb2 > Kb3 > . 二元酸溶液: Kb1 = Kw /Ka2 , Kb2 = Kw /Ka1
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(课件讲稿)4-配位滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)5-氧化还原滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)6-沉淀滴定法和滴定分析小结.pdf
- 《分析化学》课程教学资源(课件讲稿)7-重量分析法.pdf
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.3 电解质溶液的电导.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数.ppt
- 《物理化学》课程教学课件(PPT讲稿)B08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.1 可逆电池和可逆电极 §9.2 电动势的测定.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.5 电动势产生的机理 §9.6 电极电势和电池的电动势.ppt
- 《物理化学》课程教学课件(PPT讲稿)9.7 电动势测定的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)§10.1 分解电压 §10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.4 金属的电化学腐蚀、防腐与金属的钝化.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.5 化学电源.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.4 具有简单级数的反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.5 几种典型的复杂反应 §11.7 温度对反应速率的影响.ppt
- 《分析化学》课程教学资源(课件讲稿)2-误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)1-概论.pdf
- 《物理化学》课程教学课件(PPT讲稿)胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第10章 电解与极化作用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学辅导与习题详解(共十四章).pdf
- 《物理化学》课程教学课件(PPT讲稿)A08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十三章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十二章 化学动力学基础(二).ppt
