《分析化学》课程教学资源(课件讲稿)5-氧化还原滴定法

第7章氧化还原滴定法7.1氧化还原平衡7.2氧化还原滴定原理7.3氧化还原滴定中的预处理7.4常用的氧化还原滴定法7.5氧化还原滴定结果的计算
1 7.1 氧化还原平衡 7.2 氧化还原滴定原理 7.3 氧化还原滴定中的预处理 7.4 常用的氧化还原滴定法 7.5 氧化还原滴定结果的计算 第7章 氧化还原滴定法

不做考试大纲要求的内容课本7.1.4化学计量点时反应进行的程度7.2.3氧化还原滴定终点误差7.4.4其他氧化还原滴定法智慧树在线课(知到app)5.7氧化还原滴定终点误差5.13氧化还原滴定法的方法—一其他方法山东翟工大2HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 7.1.4 化学计量点时反应进行的程度 7.2.3 氧化还原滴定终点误差 7.4.4 其他氧化还原滴定法 2 不做考试大纲要求的内容 课本 智慧树在线课(知到app) 5.7 氧化还原滴定终点误差 5.13 氧化还原滴定法的方法——其他方法

7.1氧化还原平衡7.1.1概述氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的来表示。电极电势例电对半反应电极电势氧化还原电对Ce4+ +e' =Ce3+PO, /R,Oi +ze =Ri6= 1.61VDFe3+ +e' =- Fe?+O2 /R2O2 +z2e =RP2β°= 0.777V如果,>,有氧化还原反应z,O, +z,R, = z,R, +z,O,03+Ce4+ + Fe2+ = Ce3+ + Fe山东翟工大室3SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry O1 R1 氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的 电极电势 来表示。 电对半反应 电极电势 O R 1 1 1 z e 1 O R 2 2 2 z e 2 z z z z 2 1 1 2 2 1 1 2 O R R O 3 2 F e e F e 例 0 777V θ . 4 3 C e e C e 1.61V 4 2 3 3 C e F e C e F e 氧化还原电对 O2 R 2 氧化还原平衡 概 述 3

能斯特方程回顾氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的电极电势来表示。可逆氧化还原电对的电极电势可用能斯特方程来表示O+ze- = R0.059VO(25℃)Φ=@1gRZ标准电势:当电对的氧化态[O|和还原态[R|的浓度为1mol/L时的电极电势。(附表15)山东理工大4HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 4 氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的电 极电势 来表示。 可逆氧化还原电对的电极电势可用能斯特方程来表示。 0.059 [O] lg (25 ) [R] V C z O R z e 标准电势φ ө : 当电对的氧化态[O]和还原态[R]的浓度为 1mol/L时的电极电势。(附表15) 能斯特方程回顾
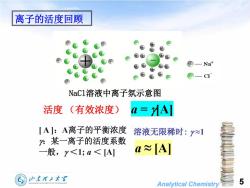
离子的活度回顾4F-NatH-CTNaC1溶液中离子氛示意图活度a= MA](有效浓度)【A]:A离子的平衡浓度溶液无限稀时:~1:某一离子的活度系数a~[A]一般,<1;a<[A]山东理工大5SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 活度 (有效浓度) [ A ]:A离子的平衡浓度 :某一离子的活度系数 一般, <1; a < [A] a = [A] 溶液无限稀时: ≈1 NaCl溶液中离子氛示意图 a ≈ [A] 5 离子的活度回顾

氧化还原反应实质:得失电子,电子转移(氧化剂得到电子被还原,还原剂失去电子被氧化)氧化还原电对对称电对:氧化态和还原态的系数相同如: Fe3+ + e'= Fe2+Mn0+8H++5e=Mn2++4H,0氧化态与还原态系数不同不对称电对:如:I+2e-=2I-Cr,0,2- + 14H+ + 6e- = 2Cr3+ + 7H,0山东理工大6HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 氧化还原电对 对称电对:氧化态和还原态的系数相同 如: Fe3+ + e - = Fe2+ MnO4 - + 8H+ + 5e - = Mn2+ + 4H2O 不对称电对:氧化态与还原态系数不同 如: I2 + 2e - = 2I - Cr2O7 2- + 14H+ + 6e - = 2Cr3+ + 7H2O 氧化还原反应实质:得失电子, 电子转移(氧化 剂得到电子被还原,还原剂失去电子被氧化) 6

可逆/不可逆电对可逆电对:任一瞬间都能建立平衡,符合能斯特方程如:Fe3+/Fe2+,I,/I-等不可逆电对:不能在反应的任一瞬间建立起平衡,实际电势与理论电势相差较大。以能斯特公式计算所得的结果,仅作参考。等如: Cr,O,2-/Cr3+, MnO4/Mn2+能斯特方程:表示可逆氧化还原电对的电极电位0.059ao25°°℃gD=a山东理工大7SHANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 可逆电对:任一瞬间都能建立平衡,符合能斯特方程 如:Fe3+/Fe2+ , I2 /I- 等 不可逆电对:不能在反应的任一瞬间建立起平衡,实际电势 与理论电势相差较大。以能斯特公式计算所得 的结果,仅作参考。 如:Cr2O7 2- /Cr3+, MnO4 - /Mn2+ 等 可逆/不可逆电对 7 能斯特方程:表示可逆氧化还原电对的电极电位 O 0.059 lg (25 ) R a z a ℃

注意:(1) z:电对的电子转移数(2)β:标准电极电位,温度的函数,t=25℃时,ao=αr=1mol/L时的电极电位,β可查表(p407表15)。>高,其氧化型的氧化能力强,可氧化电位比它低的还原剂>β°低,其还原型的还原能力强,可还原电位比它高的氧化剂。>β随[H而改变,随a和a而变化。25℃,r=1.忽略离子间相互作用0.059O(25°℃D二1[R]山东翟工大8HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry (1) z:电对的电子转移数 (2) φ θ: 标 准 电 极 电 位 , 温 度 的 函 数 , t=25℃ 时 , aO =aR =1mol/L时的电极电位, φ θ可查表(p407 表15)。 φ θ 高,其氧化型的氧化能力强,可氧化电位比它低的还原剂。 φ θ 低,其还原型的还原能力强,可还原电位比它高的氧化剂。 25℃,r = 1, 忽略离子间相互作用 φ随[H+ ]而改变,随 aO和 aR而变化。 0.059 [O] lg (25 ) z R[ ] ℃ 注意: 8

7.1.2条件电势0.059do(25℃)1gaRZ当氧化型,还原型存在副反应时,其有效浓度发生变化ao = [O]=roCo /αoaR=YR[R]=RCR/aRYOQR0.0590.0590=@0+Ig+IgRαCZ.7.R=β(条件电势)山东翟工大9SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 9 条件电势 O 0.059 lg (25 ) R a z a ℃ [O] O O a O O O C / [R ] R R a R R R C / 当氧化型,还原型存在副反应时,其有效浓度发生变化 =φ (条件电势) 0.059 lg 0.059 lg z c O z φ=φ + OR RO c R

:在给定条件下,当氧化态总浓度和标准条件电极电势还原态总浓度均为1mol/L时的实际电势,校正了活度系数和副反应系数后的电极电势值。(附表16)β"与p的关系如同K'My与KMy一样,是在一定实验条件下,衡量反应方向的尺度。在实际条件下,应用β代替β。0.059VH10=10RFe3+/Fe2+[例如]电对β0= 0.77V1mol/L的HCIO4中β0= 0.74V2mol/L的H,PO,中β0'= 0.46V1mol/L的H,SO4中Φ0'= 0.68V0.5mol/L的HCI中β0'= 0.71V山东翟工大10HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 0.059V lg O R c z c 标准条件电极电势 φ θ’:在给定条件下,当氧化态总浓度和 还原态总浓度均为1mol/L时的实际电势,校正了活度系数 和副反应系数后的电极电势值。(附表16) φ θ'与φ θ的关系如同K'MY与KMY一样,是在一定实验条件下,衡 量反应方向的尺度。在实际条件下,应用φ θ'代替φ θ 。 [例如]电对 Fe3+/Fe2+ φ θ = 0.77V 1mol/L的HClO4中 φ θ' = 0.74V 2mol/L的H3PO4中 φ θ' = 0.46V 1mol/L的H2 SO4中 φ θ' = 0.68V 0.5mol/L的HCl中 φ θ' = 0.71V 10
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(课件讲稿)6-沉淀滴定法和滴定分析小结.pdf
- 《分析化学》课程教学资源(课件讲稿)7-重量分析法.pdf
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.3 电解质溶液的电导.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数.ppt
- 《物理化学》课程教学课件(PPT讲稿)B08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.1 可逆电池和可逆电极 §9.2 电动势的测定.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.5 电动势产生的机理 §9.6 电极电势和电池的电动势.ppt
- 《物理化学》课程教学课件(PPT讲稿)9.7 电动势测定的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)§10.1 分解电压 §10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.4 金属的电化学腐蚀、防腐与金属的钝化.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.5 化学电源.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.4 具有简单级数的反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.5 几种典型的复杂反应 §11.7 温度对反应速率的影响.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.8 关于活化能 §11.9 链反应 §11.10 拟定反应历程的一般方法.ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一)习题课.ppt
- 《分析化学》课程教学资源(课件讲稿)4-配位滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)3-酸碱滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)2-误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)1-概论.pdf
- 《物理化学》课程教学课件(PPT讲稿)胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第10章 电解与极化作用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学辅导与习题详解(共十四章).pdf
- 《物理化学》课程教学课件(PPT讲稿)A08章 电解质溶液.ppt
