《物理化学》课程教学课件(PPT讲稿)§11.8 关于活化能 §11.9 链反应 §11.10 拟定反应历程的一般方法

山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY米$ 11.8关于活化能活化能概念的进一步说明理工活化能与温度的关系活化能的估算
1 *§11.8 关于活化能 活化能概念的进一步说明 活化能与温度的关系 活化能的估算

山东理工大客* S 11.8关于活化能SHANDONGUNIVERSITYOFTECHNOLOGY活化能概念的进一步说明概述在Arrhenius经验式中,把活化能看作是与温度无关的常数,这在一定的温度范围内与实验结果是相符的。如果实验温度范围适当放宽或对于较复杂的反应就不是一条很好的直线,这表明活化能与温度有关,而且Arrhenius经验式对某些历程复杂的反应不适用。对于基元反应,活化能有较明确的物理意义,而复杂反应的活化能仅是基元反应活化能的特定组合
2 在Arrhenius经验式中,把活化能看作是与温度无关 的常数,这在一定的温度范围内与实验结果是相符的。 对于基元反应,活化能有较明确的物理意义,而 复杂反应的活化能仅是基元反应活化能的特定组合。 如果实验温度范围适当放宽或对于较复杂的反应, 就不是一条很好的直线,这表明活化能与温度有关,而 且Arrhenius经验式对某些历程复杂的反应不适用。 活化能概念的进一步说明 *§11.8 关于活化能 概述

山东理工大客* $ 11.8关于活化能SHANDONGUNIVERSITYOFTECHNOLOGY活化能概念的进一步说明基元反应的活化能Tolman用统计平均的概念对基元反应的活化能下了一个定义:活化分子的平均能量与反应物分子平均能量之差值,称为活化能。E, =E -ER设基元反应为PA正、逆反应的活化能E.和E可以用图表示
3 Tolman 用统计平均的概念对基元反应的活化能下了一个 定义:活化分子的平均能量与反应物分子平均能量之差值, 称为活化能。 设基元反应为 A P 正、逆反应的活化能 Ea 和 ' 可以用图表示。 Ea * R E E E a = − *§11.8 关于活化能 活化能概念的进一步说明 基元反应的活化能
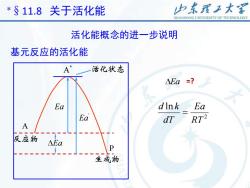
山东理工大客* $ 11.8关于活化能SHANDONGUNIVERSITYOFTECHNOLOGY活化能概念的进一步说明基元反应的活化能A*活化状态=?NEaEadlnkEaEaRT2dTA反应物AEaP生成物
4 EaEa ' Ea * A A P 基元反应的活化能 *§11.8 关于活化能 活化能概念的进一步说明 Ea =? 2 ln RT Ea dT d k =

山东理工大客* $ 11.8关于活化能SHANDONGUNIVERSITYOFTECHNOLOGY活化能概念的进一步说明基元反应的活化能假设有一基元反应(低压气相反应)k.理工A + BC+ DkEEdlnkd lnkd In(k / k_)a,+aRT2RT2dTdTdTr+= k,[A][B],r_= k_ [C][D]r+=r_时,反应达动态平衡,即k,[A]e[B]e=k_[C]e[D]
5 假设有一基元反应(低压气相反应) k+ k− A + B C + D 基元反应的活化能 活化能概念的进一步说明 *§11.8 关于活化能 dT d k dT d k+ − − ln ln − = + − 2 , 2 , RT E RT Ea a dT d ln(k / k ) + − = r+ = k+ [A][B], r−= k− [C][D] r + =r−时,反应达动态平衡,即 k+ [A]e [B]e=k− [C]e [D]e

山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY活化能概念的进一步说明基元反应的活化能[C][D]eKx=Kck[A],[B].强EEd ln Ka.+aRT2RT2dTd ln KcA.Um0nRT2dT
6 e e e e C A B C D K k k [ ] [ ] [ ] [ ] = = − + − = + − 2 , 2 , RT E RT Ea a dT d KC ln 2 RT rUm = dT d KC ln 基元反应的活化能 活化能概念的进一步说明

山东理工大客* $ 11.8关于活化能SHANDONGUNIVERSITYOFTECHNOLOGY活化能概念的进一步说明基元反应的活化能EEA,Um0a,+a.m福RT2RT2RT2则 △,Um=Um(产物)-Um(反应物)=Ea+-Ea即 Ea+Um(反应物)=E。-+Um(产物)=Um(活化态)Um(活化态):活化分子组的摩尔内能
7 则 rUm ⊙ =Um(产物) – Um(反应物) = Ea+ – Ea- 即 Ea + + Um(反应物) = Ea - + Um(产物) = Um(活化态) Um(活化态): 活化分子组的摩尔内能 *§11.8 关于活化能 − = + − 2 , 2 , RT E RT Ea a 基元反应的活化能 活化能概念的进一步说明 2 RT rUm
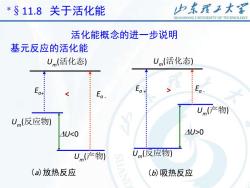
山东理工大客* $ 11.8关于活化能SHANDONGUNIVERSITYOFTECHNOLOGY活化能概念的进一步说明基元反应的活化能Um(活化态)Um(活化态)EEEaakoat.Um(产物)-Um(反应物)4U>0AU<0U(反应物)Um(产物)(a)放热反应(b)吸热反应
8 Um (活化态) Um (反应物) Um (产物) Ea+ Ea - U0 (b)吸热反应 *§11.8 关于活化能 基元反应的活化能 活化能概念的进一步说明

山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY活化能概念的进一步说明基元反应的活化能dln Ke4.Hed ln KcA.U.0mm如何推导?RT2RT2dTdT
9 2 RT rUm = dT d KC ln 如何推导? 基元反应的活化能 活化能概念的进一步说明 r m 2 d ln d K H T RT =

山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY东望
10
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一)习题课.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(12.1-12.7).ppt
- 《物理化学》课程教学课件(PPT讲稿)12.9 复习题 催化反应动力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)13章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)14章 胶体与大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 统计热力学基础计.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电解质浴液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十章 电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十一章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十二章 化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十三章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十四章 胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学(习题课).ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)13章 表面物理化学-习题课.ppt
- 《物理化学》课程教学资源(导学任务)第1次课.doc
- 《物理化学》课程教学资源(导学任务)第2次课.doc
- 《物理化学》课程教学资源(导学任务)第3次课.doc
- 《物理化学》课程教学资源(导学任务)第5次课.doc
- 《物理化学》课程教学课件(PPT讲稿)§11.5 几种典型的复杂反应 §11.7 温度对反应速率的影响.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.4 具有简单级数的反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.5 化学电源.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.4 金属的电化学腐蚀、防腐与金属的钝化.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§10.1 分解电压 §10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)9.7 电动势测定的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.5 电动势产生的机理 §9.6 电极电势和电池的电动势.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.1 可逆电池和可逆电极 §9.2 电动势的测定.ppt
- 《物理化学》课程教学课件(PPT讲稿)B08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.3 电解质溶液的电导.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《分析化学》课程教学资源(课件讲稿)7-重量分析法.pdf
- 《分析化学》课程教学资源(课件讲稿)6-沉淀滴定法和滴定分析小结.pdf
- 《分析化学》课程教学资源(课件讲稿)5-氧化还原滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)4-配位滴定法.pdf
