《物理化学》课程教学课件(PPT讲稿)12.9 复习题 催化反应动力学

s 12.9催化反应动力学催化剂与催化作用均相酸碱催化络合催化酶催化反应2025/4/4
2025/4/4 §12.9 催化反应动力学 催化剂与催化作用 均相酸碱催化 酶催化反应 络合催化

催化剂与催化作用可明显改变反应速率,而本身在反应前后数量和化学性质保持不变的物质称为催化剂。可加速反应速率的,称为正催化剂;可降低反应速率的,称为阻化剂或负催化剂工业上大部分用的是正催化剂。而塑料和橡胶中的防老剂,金属防腐用的缓蚀剂和汽油燃烧中的防爆震剂等都是阻化剂注意:催化剂是参与反应的,其物理性质有可能改变。2025/4/4
2025/4/4 催化剂与催化作用 可明显改变反应速率,而本身在反应前后数量和化学 性质保持不变的物质称为催化剂。 可加速反应速率的,称为正催化剂; 可降低反应速率的,称为阻化剂或负催化剂。 工业上大部分用的是正催化剂。而塑料和橡胶中的 防老剂,金属防腐用的缓蚀剂和汽油燃烧中的防爆震剂 等都是阻化剂 注意:催化剂是参与反应的,其物理性质有可能改变

催化剂与催化作用催化剂与反应系统处在同一个相的称为均相催化如用硫酸作催化剂使乙醇和乙酸生成乙酸乙酯的反应是液相均相反应。催化剂与反应系统处在不同相的称为多相催化。如用固体超强酸作催化剂使乙醇和乙酸生成乙酸乙酯的反应是多相催化反应。石油裂解、直链烷烃芳构化等反应也是多相催化反应。2025/4/4
2025/4/4 催化剂与反应系统处在同一个相的称为均相催化。 石油裂解、直链烷烃芳构化等反应也是多相催化反应。 如用硫酸作催化剂使乙醇和乙酸生成乙酸乙酯的反应 是液相均相反应。 催化剂与反应系统处在不同相的称为多相催化。 如用固体超强酸作催化剂使乙醇和乙酸生成乙酸乙酯 的反应是多相催化反应。 催化剂与催化作用

催化剂与催化作用ko→AB设某基元反应为A+B活化能为E。加入催化剂K后的反应机理为kAK(1) A+K(快平衡)k2ksAK+B>AB+K(2) (慢反应)用平衡假设法推导速率方程k.d[AB][AK][A][K]k,[AK][B]r=dt得:k,kk,k.[K]K[K][A][B] = k[A][B]k2k22025/4/4
2025/4/4 设某基元反应为 A B AB 0k + ⎯⎯→ 活化能为 E0 加入催化剂 K 后的反应机理为 (快平衡) 3 (2) AK B AB K k + ⎯⎯→ + (慢反应) 用平衡假设法推导速率方程 3 d[AB] [AK][B] dt r k = = 1 2 [AK] [A][K] k k = 得: 1 3 2 [K][A][B] k k r k = = k[A][B] 1 3 2 [K] k k k k = 催化剂与催化作用
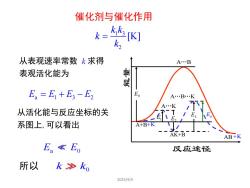
催化剂与催化作用k,k[K]k =k2从表观速率常数k求得A.B鲁骐表观活化能为EoE, = E, + E - E,A...B...K不A..K从活化能与反应坐标的关-TV/EsE1E系图上,可以看出A+B+K业AK+BAB+KE.ko2025/4/4
2025/4/4 1 3 2 [K] k k k k = 从表观速率常数 k 求得 表观活化能为 E E E E a 1 3 2 = + − 从活化能与反应坐标的关 系图上,可以看出 E E a 0 所以 k k0 A B . A B K . . A K . A+B AK+B AB E1 反应途径 能量 E0 E2 E3 Ea +K +K 催化剂与催化作用
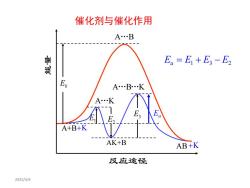
催化剂与催化作用A..B鲁骐E =E +E,-E,E.A...B...KA.KAEE,EE21A+B+KAK+BAB+K反应途径2025/4/4
2025/4/4 A B . A B K . . A K . A+B AK+B AB E1 反应途径 能量 E0 E2 E3 Ea +K +K E E E E a 1 3 2 = + − 催化剂与催化作用

催化剂与催化作用Ea(kJ-mol)反应催化剂催化反应非催化反应184.1104.62HI-H+I2AuPt244.8136.02H0-2H+0蔗糖在盐酸溶液中转化酶107.139.3的分解104.6x103AexpRTKo假定A与A相等,则184.1x103k非俄A'expRT=1.8*108
催化剂与催化作用 =1.8*108

催化剂与催化作用也有某些催化反应,活化能降低得不多,而反应速率却改变很大。有时也发现同一反应在不同的催化剂上反应,其活化能相差不大,而反应速率相差很大,这种情况可由活化摘的改变来解释。4*seE△.Hk = (c0)"mmexpexpRRTE0= AexpRT如果活化改变很大,相当于指前因子改变很大,也可以明显地改变速率常数值。2025/4/4
2025/4/4 也有某些催化反应,活化能降低得不多,而反应速率却 改变很大。有时也发现同一反应在不同的催化剂上反应,其 活化能相差不大,而反应速率相差很大,这种情况可由活化 熵的改变来解释。 ( ) ( ) 1 B r m r m r exp exp k T S H n k c h R RT − = − a exp E A RT = − 如果活化熵改变很大,相当于指前因子改变很大,也 可以明显地改变速率常数值。 催化剂与催化作用

催化剂与催化作用催化反应的特点1.催化剂加速反应速率的本质是改变了反应的历程,降低了整个反应的表观活化能2.催化剂在反应前后,化学性质没有改变,但物理性质可能会发生改变,3.催化剂不影响化学平衡,不能改变反应的方向和限度,催化剂同时加速正向和逆向反应的速率,使平衡提前到达。即不能改变热力学函数 △,Gm,△,G的值2025/4/4
2025/4/4 催化反应的特点 2.催化剂在反应前后,化学性质没有改变,但物理性 质可能会发生改变。 即不能改变热力学函数 r m r m G G , 的值 1.催化剂加速反应速率的本质是改变了反应的历程, 降低了整个反应的表观活化能。 3.催化剂不影响化学平衡,不能改变反应的方向和 限度,催化剂同时加速正向和逆向反应的速率,使平 衡提前到达。 催化剂与催化作用
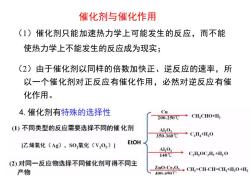
催化剂与催化作用(1)催化剂只能加速热力学上可能发生的反应,而不能使热力学上不能发生的反应成为现实:(2)由于催化剂以同样的倍数加快正、逆反应的速率,所以一个催化剂对正反应有催化作用,必然对逆反应有催化作用。Cu4.催化剂有特殊的选择性CH,CHO+H,200-250℃1)不同类型的反应需要选择不同的催化剂Al,OC,H,+H,0350-360℃EtOH[乙烯氧化(Ag),SO,氧化(VO,)】Al,OC,HoC,H+H,o140℃(2)对同一反应物选择不同催化剂可得不同主ZnO-Cr,OCH,=CH-CH=CH,+H,O+H产物100-450℃
(1)催化剂只能加速热力学上可能发生的反应,而不能 使热力学上不能发生的反应成为现实; (2)由于催化剂以同样的倍数加快正、逆反应的速率,所 以一个催化剂对正反应有催化作用,必然对逆反应有催 化作用。 催化剂与催化作用 4.催化剂有特殊的选择性 EtOH
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)13章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)14章 胶体与大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 统计热力学基础计.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电解质浴液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十章 电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十一章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十二章 化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十三章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十四章 胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学(习题课).ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)13章 表面物理化学-习题课.ppt
- 《物理化学》课程教学资源(导学任务)第1次课.doc
- 《物理化学》课程教学资源(导学任务)第2次课.doc
- 《物理化学》课程教学资源(导学任务)第3次课.doc
- 《物理化学》课程教学资源(导学任务)第5次课.doc
- 《物理化学》课程教学资源(导学任务)第8次课.doc
- 《物理化学》课程教学资源(导学任务)第14次课.doc
- 《物理化学》课程教学资源(导学任务)第18次课.doc
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(12.1-12.7).ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一)习题课.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.8 关于活化能 §11.9 链反应 §11.10 拟定反应历程的一般方法.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.5 几种典型的复杂反应 §11.7 温度对反应速率的影响.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.4 具有简单级数的反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.5 化学电源.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.4 金属的电化学腐蚀、防腐与金属的钝化.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§10.1 分解电压 §10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)9.7 电动势测定的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.5 电动势产生的机理 §9.6 电极电势和电池的电动势.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.1 可逆电池和可逆电极 §9.2 电动势的测定.ppt
- 《物理化学》课程教学课件(PPT讲稿)B08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.3 电解质溶液的电导.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《分析化学》课程教学资源(课件讲稿)7-重量分析法.pdf
