《物理化学》课程教学课件(PPT讲稿)第十章 电解与极化作用
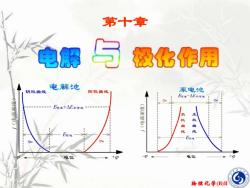
第十章与电解极化作用电解池原电池阳极曲线阴极曲线E可送一△E不可送EAE可送十AE不可送(正负极极曲曲线线E可送Egr送Threnu电位-电位O物理化学(B)II
物理化学(B)II 第十章

第十章电解与极化作用s10.1 分解电压s10.2极化作用S10.3电解时电极上的竞争反应S10.4金属的电化学腐蚀、防腐与金属的钝化s 10.5 化学电源*s10.5电有机合成简介物理化学(B)I
物理化学(B)II 第十章电解与极化作用 §10.1 分解电压 §10.3 电解时电极上的竞争反应 §10.2 极化作用 §10.4 金属的电化学腐蚀、防腐与金属的钝化 §10.5 化学电源 *§10.5 电有机合成简介

s 10.1理论分解电压理论分解电压使某电解质溶液能连续不断发生电解时所必须外加的最小电压,在数值上等于该电解池作为可逆电池时的可逆电动势E(理论分解)=E(可逆物理化学(B)II
物理化学(B)II §10.1 理论分解电压 理论分解电压 使某电解质溶液能连续不断发生 电解时所必须外加的最小电压,在数值上等于该电 解池作为可逆电池时的可逆电动势 E E ( ) ( ) 理论分解 可逆 =
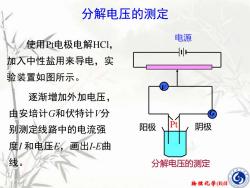
分解电压的测定电源使用Pt电极电解HCl,加入中性盐用来导电,实验装置如图所示。逐渐增加外加电压,由安培计G和伏特计V分Pt阴极阳极别测定线路中的电流强度I和电压E,画出I-E曲线。分解电压的测定物理化学(B)II
物理化学(B)II 分解电压的测定 使用Pt电极电解HCl, 加入中性盐用来导电,实 验装置如图所示。 逐渐增加外加电压, 由安培计G和伏特计V分 别测定线路中的电流强 度I 和电压E,画出I-E曲 线。 电源 分解电压的测定 阳极 Pt 阴极 V G
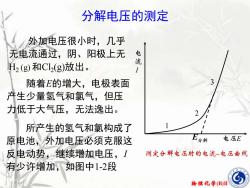
分解电压的测定外加电压很小时,几乎电无电流通过,阴、阳极上无流H2 (g) 和Cl(g)放出。13随着E的增大,电极表面产生少量氢气和氯气,但压力低于大气压,无法逸出。所产生的氢气和氯构成了E分解电压E原电池,外加电压必须克服这反电动势,继续增加电压,I测定分解电压时的电流一电压曲线有少许增加,如图中1-2段物理化学(B)II
物理化学(B)II 外加电压很小时,几乎 无电流通过,阴、阳极上无 H2 (g) 和Cl2 (g)放出。 随着E的增大,电极表面 产生少量氢气和氯气,但压 力低于大气压,无法逸出。 E I E 1 2 3 所产生的氢气和氯构成了 原电池,外加电压必须克服这 反电动势,继续增加电压,I 有少许增加,如图中1-2段 分解电压的测定

分解电压的测定当外压增至2-3段,氢电气和氯气的压力等于大流T气压力,呈气泡逸出,反电3动势达极大值 Eb,max。再增加电压,使I迅速增加。将直线外延至I=0处,得E(分解)值,这是使电解E分解电压E池不断工作所必需外加的测定分解电压时的电流一电压曲线最小电压,称为分解电压物理化学(B)II
物理化学(B)II 当外压增至2-3段,氢 气和氯气的压力等于大 气压力,呈气泡逸出,反电 动势达极大值 Eb,max。 再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解 池不断工作所必需外加的 最小电压,称为分解电压。 E I E 1 2 3 分解电压的测定

实际分解电压要使电解池顺利地进行连续反应,除了克服作为原电池时的可逆电动势外,还要克服由于极化在阴、阳极上产生的超电势n(阴)和n(阳),以及克服电池电阻所产生的电位降IR。这三者的加和就称为实际分解电压。E(分解)= E(可逆)+△E(不可逆)+IR△E(不可逆)=n(阳)+n(阴显然分解电压的数值会随着通入电流强度的增加而增加物理化学(B)II
物理化学(B)II E E E IR ( ) ( ) ( ) 分解 可逆 不可逆 = + + 要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势 和 ,以及克服电 池电阻所产生的电位降 。这三者的加和就称为实 际分解电压。 ( ) 阴 ( ) 阳 IR 显然分解电压的数值会随着通入电流强度的增加而 增加。 实际分解电压 = + E( ) ( ) ( ) 不可逆 阳 阴

S 10.2极化作用极化(polarization)当电极上无电流通过时,电极处于平衡状态,这时的电极电势分别称为阳极可逆(平衡)电势和阴极可逆(平衡)电势(阴)阳),可逆β可逆在有电流通过时,随着电极上电流密度的增加电极实际分解电势值对平衡值的偏离也愈来愈大,这种对可逆平衡电势的偏离称为电极的极化物理化学(B)I
物理化学(B)II 极化(polarization) 当电极上无电流通过时,电极处于平衡状态, 这时的电极电势分别称为阳极可逆(平衡)电势和阴极 可逆(平衡)电势 可逆(阳),可逆(阴) 在有电流通过时,随着电极上电流密度的增加, 电极实际分解电势值对平衡值的偏离也愈来愈大,这 种对可逆平衡电势的偏离称为电极的极化。 §10.2 极化作用

S 10.2极化作用根据极化产生的不同原因,通常把极化大致分为两类:浓差极化和电化学极化(1)浓差极化在电解过程中,电极附近某离子浓度由于电极反应而发生变化,本体溶液中离子扩散的速度又赶不上弥补这个变化,就导致电极附近溶液的浓度与本体溶液间有一个浓度梯度,这种浓度差别引起的电极电势的改变称为浓差极化。用搅拌和升温的方法可以减少浓差极化也可以利用滴汞电极上的浓差极化进行极谱分析物理化学(B)II
物理化学(B)II 根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。 §10.2 极化作用 用搅拌和升温的方法可以减少浓差极化 也可以利用滴汞电极上的浓差极化进行极谱分析

S 10.2极化作用例如电解一定浓度的硝酸银溶液阴极反应Ag(maa+)+e →Ag(s)RT1poInβ可逆Ag*|AgFaAg电解时1RT0Inβ不可逆AgtlAgFaAgaRTAg7阴=(可逆一P不可逆)阴InFae, Ag*aQAg*e,Ag可逆不可逆阳极上有类似的情况,但?不可褪可逆C物理花学(B)II
物理化学(B)II 例如电解一定浓度的硝酸银溶液 §10.2 极化作用 + + Ag Ag ( ) e Ag(s) m − 阴极反应 + ⎯⎯→ + Ag |Ag Ag 1 ln RT F a 可逆 = − + 电解时 Ag |Ag e Ag 1 ln RT F a + + 不可逆 = − , 阴 阴 = − ( ) 可逆 不可逆 Ag e Ag ln RT a F a + + = , e,Ag Ag a + 不可逆 阳极上有类似的情况,但 可逆 < 不可逆
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第十一章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十二章 化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十三章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十四章 胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学(习题课).ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)13章 表面物理化学-习题课.ppt
- 《物理化学》课程教学资源(导学任务)第1次课.doc
- 《物理化学》课程教学资源(导学任务)第2次课.doc
- 《物理化学》课程教学资源(导学任务)第3次课.doc
- 《物理化学》课程教学资源(导学任务)第5次课.doc
- 《物理化学》课程教学资源(导学任务)第8次课.doc
- 《物理化学》课程教学资源(导学任务)第14次课.doc
- 《物理化学》课程教学资源(导学任务)第18次课.doc
- 《物理化学》课程教学资源(导学任务)第23次课.doc
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第3章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第4章 多组分系统热力学及其在溶液中的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第5章 相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电解质浴液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 统计热力学基础计.ppt
- 《物理化学》课程教学课件(PPT讲稿)14章 胶体与大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)13章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)12.9 复习题 催化反应动力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(12.1-12.7).ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一)习题课.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.8 关于活化能 §11.9 链反应 §11.10 拟定反应历程的一般方法.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.5 几种典型的复杂反应 §11.7 温度对反应速率的影响.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.4 具有简单级数的反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.5 化学电源.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.4 金属的电化学腐蚀、防腐与金属的钝化.ppt
- 《物理化学》课程教学课件(PPT讲稿)10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§10.1 分解电压 §10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)9.7 电动势测定的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.5 电动势产生的机理 §9.6 电极电势和电池的电动势.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.1 可逆电池和可逆电极 §9.2 电动势的测定.ppt
