《物理化学》课程教学课件(PPT讲稿)10.4 金属的电化学腐蚀、防腐与金属的钝化

S 10.4 金属的电化学腐蚀、防腐与金属的钝化大SHANDONGUNIVERSITYOFTECHNOLOGY金属腐蚀分两类:(1)化学腐蚀金属表面与介质如气体或非电解质液体等因发生化学作用而引起的腐蚀,称为化学腐蚀。化学腐蚀作用进行时无电流产生(2)电化学腐蚀金属表面与介质如潮湿空气或电解质溶液等,因形成微电池,金属作为阳极发生氧化而使金属发生腐蚀。这种由于电化学作用引起的腐蚀称为电化学腐蚀
金属腐蚀分两类: (1)化学腐蚀 金属表面与介质如气体或非电 解质液体等因发生化学作用而引起的腐蚀,称为化 学腐蚀。化学腐蚀作用进行时无电流产生。 (2)电化学腐蚀 金属表面与介质如潮湿空气或 电解质溶液等,因形成微电池,金属作为阳极发生 氧化而使金属发生腐蚀。这种由于电化学作用引起 的腐蚀称为电化学腐蚀。 §10.4 金属的电化学腐蚀、防腐与金属的钝化
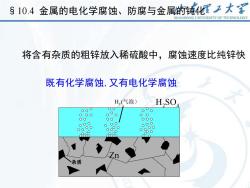
S 10.4 金属的电化学腐蚀、防腐与金属的钝化大享SHANDONGUNIVERSITYOFTECHNOLOGY将含有杂质的粗锌放入稀硫酸中,腐蚀速度比纯锌快既有化学腐蚀,又有电化学腐蚀H(气泡)H,so杂质
将含有杂质的粗锌放入稀硫酸中,腐蚀速度比纯锌快 既有化学腐蚀,又有电化学腐蚀 Zn 杂质 H (2 气泡) H SO2 4 §10.4 金属的电化学腐蚀、防腐与金属的钝化

S 10.4 金属的电化学腐蚀、防腐与金属的钝化大客SHANDONGUNIVERSITYOFTECHNOLOGY电化学腐蚀铜板上的铁铆钉为什么特别容易生锈?暴露在空气中,表面被潮湿空气或雨水浸润Fe"O202CO2SO空气中的和海边 CO,,SO,7V空气中的NaCI溶解其中H20H0HH形成电解质溶液,这样组CuCuFo成了原电池铜作阴极,铁作阳极电化学磨蚀示意图所以铁很快腐蚀形成铁锈
铜板上的铁铆钉为什么特别容易生锈? 暴露在空气中,表面 被潮湿空气或雨水浸润, 空气中的 和海边 空气中的NaCl溶解其中, 形成电解质溶液,这样组 成了原电池 CO ,SO 2 2 铜作阴极,铁作阳极 所以铁很快腐蚀形成铁锈。 §10.4 金属的电化学腐蚀、防腐与金属的钝化 电化学腐蚀
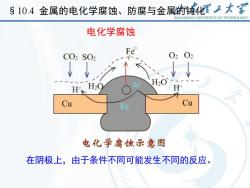
S 10.4 金属的电化学腐蚀、防腐与金属的钝化大享SHANDONGUNIVERSITYOFTECHNOLOGY电化学腐蚀Fe02O2CO2SO小R业业V-H20H20H+HCuCu.电化学腐蚀示意图在阴极上,由于条件不同可能发生不同的反应
在阴极上,由于条件不同可能发生不同的反应。 §10.4 金属的电化学腐蚀、防腐与金属的钝化 电化学腐蚀

s 10.4 金属的电化学腐蚀、防腐与金属的钝化大客SHANDONGUNIVERSITYOFTECHNOLOGY电化学腐蚀时阴极上的反应(1)析氢腐蚀酸性介质中H在阴极上还原成氢气析出RTaH2H*+e →}H,(g)β(HH,)In)三FaH设 α, =1, α =10-7@(H+H,)= -0.413 V铁阳极氧化,当a(Fe2t)=10-°时认为已经发生腐蚀,RT1p(Fe2+|Fe)= βp(Fe2+|Fe)--0.617VT10-6zF这时组成原电池的电动势为0.204V,是自发电池
(1)析氢腐蚀 酸性介质中 在阴极上还原成氢气析出。 + H 2 + + + H 2 2 H 1 2 H e H (g) (H |H ) ln RT a F a − + → = − 设 + 2 7 H H a a 1, 10− = = + 2 (H |H ) 0.413 V = − 铁阳极氧化,当 时认为已经发生腐蚀, 2+ 6 a(Fe ) 10− = 2+ 2+ 6 1 (Fe |Fe) (Fe |Fe) ln 10 0.617V RT zF − = − = − 这时组成原电池的电动势为0.204V,是自发电池。 电化学腐蚀时阴极上的反应 §10.4 金属的电化学腐蚀、防腐与金属的钝化

S 10.4 金属的电化学腐蚀、防腐与金属的钝化大SHANDONGUNIVERSITYOFTECHNOLOGY电化学腐蚀时阴极上的反应(2)耒耗氧腐蚀如果既有酸性介质,又有氧气存在,在阴极上发生消耗氧的还原反应:O2(g)+4H+ +4e- →2H,0RT10p(O2H,O,H+) = @β =1.229 VnC4Fao,an设 ao,=1, aμ+ =10-7,则 p(O,IH,0,Ht)=0.816V这时与E(Fe2+|Fe)(-0.617V)阳极组成原电池的电动势为 1.433 V显然耗氧腐蚀比析氢腐蚀严重得多
如果既有酸性介质,又有氧气存在,在阴极上发 生消耗氧的还原反应: 这时与 (-0.617V)阳极组成原电池的电动 势为 2+ E(Fe |Fe) 1.433 V (2)耗氧腐蚀 + 2 + O 2 2 7 H 1, 10 , a a (O |H O,H ) 0.816V − 设 则 = = = + O (g)+4H 4e 2H O 2 2 − + → =1.229 V + 2 + 2 2 4 O H 1 (O |H O,H ) ln 4 RT F a a = − 显然耗氧腐蚀比析氢腐蚀严重得多。 电化学腐蚀时阴极上的反应 §10.4 金属的电化学腐蚀、防腐与金属的钝化

S 10.4 金属的电化学腐蚀、防腐与金属的钝化大SHANDONGUNIVERSITYOFTECHNOLOGY铁锈的组成铁在酸性介质中只能氧化成二价铁:Fe(s) →> Fe2+ + 2e品二价铁被空气中的氧气氧化成三价铁,三价铁在水溶液中生成沉淀,Fe(OH),又可能部分失水Fe(OH);Fe,O3生成等所以铁锈是一个由Fe2+, Fe3+, Fe(OH)3, Fe,O,化合物组成的疏松的混杂物质
铁在酸性介质中只能氧化成二价铁: 2+ Fe(s) Fe 2e → + − 二价铁被空气中的氧气氧化成三价铁,三价铁在水 溶液中生成 沉淀, 又可能部分失水 生成 Fe(OH)3 Fe(OH)3 Fe O2 3 所以铁锈是一个由 等 化合物组成的疏松的混杂物质。2+ 3+ Fe ,Fe ,Fe(OH) ,Fe O 3 2 3 铁锈的组成 §10.4 金属的电化学腐蚀、防腐与金属的钝化

S 10.4 金属的电化学腐蚀、防腐与金属的钝化大SHANDONGUNIVERSITYOFTECHNOLOGY电化学腐蚀在金属表面上形成浓差电池也可构成电化学腐蚀。例如:将两个铁电极放在稀的NaCI溶液中,其中一个电极(A)上通以空气,另一电极(B)通以富氮空气,由于两电极附近含氮量的不同,可构成浓差电池,其电极反应为Fe → Fe2+ +2e阳极(B)=O2(g)+H,0+2e →20H阴极(A)2实际中,若同一根铁管,若局部处于氧浓度较低处,就能形成浓差电池,使作为阳极的部分受到腐蚀
在金属表面上形成浓差电池也可构成电化学腐蚀。 例如:将两个铁电极放在稀的NaCl溶液中,其中一个电 极(A)上通以空气,另一电极(B)通以富氮空气,由于两电极 附近含氮量的不同,可构成浓差电池,其电极反应为 阳极(B) 阴极(A) 实际中,若同一根铁管,若局部处于氧浓度较低处,就 能形成浓差电池,使作为阳极的部分受到腐蚀。 2 2 1 O (g) H O 2e 2OH 2 − − + + → 2 Fe Fe 2e → ++ − 电化学腐蚀 §10.4 金属的电化学腐蚀、防腐与金属的钝化

S 10.4 金属的电化学腐蚀、防腐与金属的钝化大SHANDONGUNIVERSITYOFTECHNOLOGY电化学腐蚀腐蚀电池电动势的大小影响腐蚀的倾向和腐蚀速度当两种金属构成微电池时,由于有电流产生,电极就要发生极化,极化作用的结果会改变腐蚀电池的电动势,因此,要研究极化对腐蚀的影响时,特别是研究金属在各种介质中的极化曲线有重要的意义
腐蚀电池电动势的大小影响腐蚀的倾向和腐蚀速度。 当两种金属构成微电池时,由于有电流产生,电极 就要发生极化,极化作用的结果会改变腐蚀电池的电动 势,因此,要研究极化对腐蚀的影响时,特别是研究金 属在各种介质中的极化曲线有重要的意义。 §10.4 金属的电化学腐蚀、防腐与金属的钝化 电化学腐蚀

S 10.4 金属的电化学腐蚀、防腐与金属的钝化大SHANDONGUNIVERSITYOFTECHNOLOGY金属的防腐(1)非金属防腐在金属表面涂上油漆、塘瓷、塑料、沥青等,将金属与腐蚀介质隔开。(2)金属保护层在需保护的金属表面用电镀或化学镀的方法镀上Au,Ag,Ni,Cr,Zn,Sn等金属,保护内层不被腐蚀。按照腐蚀的性质,金属保护层可分为阳极保护层和阴极保护层
(1)非金属防腐 在金属表面涂上油漆、搪瓷、塑料、 沥青等,将金属与腐蚀介质隔开。 (2)金属保护层 在需保护的金属表面用电镀或化学镀 的方法镀上Au,Ag,Ni,Cr,Zn,Sn等金属,保护内层不被 腐蚀。按照腐蚀的性质,金属保护层可分为阳极保护层和阴极 保护层。 金属的防腐 §10.4 金属的电化学腐蚀、防腐与金属的钝化
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)10.5 化学电源.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.4 具有简单级数的反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.5 几种典型的复杂反应 §11.7 温度对反应速率的影响.ppt
- 《物理化学》课程教学课件(PPT讲稿)§11.8 关于活化能 §11.9 链反应 §11.10 拟定反应历程的一般方法.ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一)习题课.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(12.1-12.7).ppt
- 《物理化学》课程教学课件(PPT讲稿)12.9 复习题 催化反应动力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)13章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)14章 胶体与大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 统计热力学基础计.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电解质浴液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十章 电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十一章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十二章 化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十三章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十四章 胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学(习题课).ppt
- 《物理化学》课程教学课件(PPT讲稿)11章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)§10.1 分解电压 §10.3 电解时电极上的竞争反应.ppt
- 《物理化学》课程教学课件(PPT讲稿)9.7 电动势测定的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.5 电动势产生的机理 §9.6 电极电势和电池的电动势.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)§9.1 可逆电池和可逆电极 §9.2 电动势的测定.ppt
- 《物理化学》课程教学课件(PPT讲稿)B08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数.ppt
- 《物理化学》课程教学课件(PPT讲稿)§8.3 电解质溶液的电导.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《分析化学》课程教学资源(课件讲稿)7-重量分析法.pdf
- 《分析化学》课程教学资源(课件讲稿)6-沉淀滴定法和滴定分析小结.pdf
- 《分析化学》课程教学资源(课件讲稿)5-氧化还原滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)4-配位滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)3-酸碱滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)2-误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)1-概论.pdf
- 《物理化学》课程教学课件(PPT讲稿)胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
