《物理化学》课程教学课件(PPT讲稿)第十章 电解与极化作用

第十章 归东理王大彩 SHANDONG UNIVERSITY OF TECHNOLOGY 电服 与 微化作用 电解池 阴极曲线 阳极曲线 原电池 E送-△E不可送 可十△E不可 负枫曲 线 正极曲线 E 电位 电位
- 1 - 第十章

第十章 电解与极化作用 中东理王大得 SHANDONG UNIVERSITY OF TECHNOLOGY §10.1分解电压 §10.2极化作用 §10.3电解时电极上的竞争反应 §10.4金属的电化学腐蚀、防腐与金属的钝化 §10.5化学电源 *§10.5电有机合成简介
§10.1 分解电压 §10.3 电解时电极上的竞争反应 §10.2 极化作用 §10.4 金属的电化学腐蚀、防腐与金属的钝化 §10.5 化学电源 *§10.5 电有机合成简介 第十章 电解与极化作用 - 2 -

§10.1理论分解电压 归东理子大彩 SHANDONG UNIVERSITY OF TECHNOLOGY 理论分解电压 使某电解质溶液能连续不断发生 电解时所必须外加的最小电压,在数值上等于该电 解池作为可逆电池时的可逆电动势 E(理论分解)=E(可逆) -3-
理论分解电压 使某电解质溶液能连续不断发生 电解时所必须外加的最小电压,在数值上等于该电 解池作为可逆电池时的可逆电动势 E E ( ) ( ) 理论分解 可逆 = - 3 - §10.1 理论分解电压
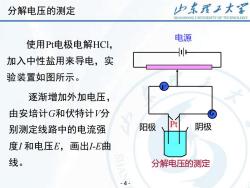
分解电压的测定 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 电源 使用Pt电极电解HCl, 加入中性盐用来导电,实 验装置如图所示。 逐渐增加外加电压, 由安培计G和伏特计V分 别测定线路中的电流强 阳极 阴极 度I和电压E,画出1-E曲 线。 分解电压的测定 4
使用Pt电极电解HCl, 加入中性盐用来导电,实 验装置如图所示。 逐渐增加外加电压, 由安培计G和伏特计V分 别测定线路中的电流强 度I 和电压E,画出I-E曲 线。 电源 分解电压的测定 阳极 Pt 阴极 V G - 4 - 分解电压的测定

分解电压的测定 归东理子大彩 SHANDONG UNIVERSITY OF TECHNOLOGY 外加电压很小时,几乎 无电流通过,阴、阳极上无 流 H2(g)和C2(g)放出。 随着E的增大,电极表面 产生少量氢气和氯气,但压 力低于大气压,无法逸出。 所产生的氢气和氯构成了 原电池,外加电压必须克服这 E分解 电压E 反电动势,继续增加电压,1 测定分解电压时的电流电压曲线 有少许增加,如图中1-2段 5
外加电压很小时,几乎 无电流通过,阴、阳极上无 H2 (g) 和Cl2 (g)放出。 随着 E的增大,电极表面 产生少量氢气和氯气,但压 力低于大气压,无法逸出。 E I E 1 2 3 所产生的氢气和氯构成了 原电池,外加电压必须克服这 反电动势,继续增加电压,I 有少许增加,如图中 1 - 2 段 - 5 - 分解电压的测定
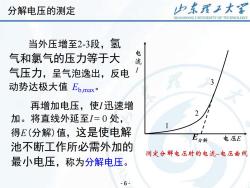
分解电压的测定 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 当外压增至2-3段,氢 气和氯气的压力等于大 电流 气压力,呈气泡逸出,反电 动势达极大值Eb.max 再增加电压,使I迅速增 加。将直线外延至I=0处, 得E(分解)值,这是使电解 电压E 池不断工作所必需外加的 卫分解 测定分解电压时的电流-电压曲线 最小电压,称为分解电压。 6
当外压增至 2 - 3段, 氢 气和氯气的压力等于大 气压力,呈气泡逸出,反电 动势达极大值 Eb,max 。 再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解 池不断工作所必需外加的 最小电压,称为分解电压 。 E I E 1 2 3 - 6 - 分解电压的测定

实际分解电压 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势n阴和阳),以及克服电 池电阻所产生的电位降R。这三者的加和就称为实 际分解电压。 E(分解)=E(可逆)+△E(不可逆)+IR △E(不可逆)=阳)+7(阴) 显然分解电压的数值会随着通入电流强度的增加而 增加
E E E IR ( ) ( ) ( ) 分解 可逆 不可逆 = + + 要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势 和 ,以及克服电 池电阻所产生的电位降 。这三者的加和就称为实 际分解电压。 ( ) 阴 ( ) 阳 IR 显然分解电压的数值会随着通入电流强度的增加而 增加。 = + E( ) ( ) ( ) 不可逆 阳 阴 - 7 - 实际分解电压

§10.2极化作用 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 极化(polarization) 当电极上无电流通过时,电极处于平衡衡状态, 这时的电极电势分别称为阳极可逆(平衡)电势和阴极 可逆(平衡)电势 p逆(阳),p可迪(阴) 在有电流通过时,随着电极上电流密度的增加, 电极实际分解电势值对平衡值的偏离也愈来愈大,这 种对可逆平衡电势的偏离称为电极的极化
极化(polarization) 当电极上无电流通过时,电极处于平衡状态, 这时的电极电势分别称为阳极可逆(平衡)电势和阴极 可逆(平衡)电势 可逆(阳),可逆(阴) 在有电流通过时,随着电极上电流密度的增加, 电极实际分解电势值对平衡值的偏离也愈来愈大,这 种对可逆平衡电势的偏离称为电极的极化。 - 8 - §10.2 极化作用

§10.2极化作用 归东理子大彩 SHANDONG UNIVERSITY OF TECHNOLOGY 根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。 用搅拌和升温的方法可以减少浓差极化 也可以利用滴汞电极上的浓差极化进行极谱分析。 9
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。 用搅拌和升温的方法可以减少浓差极化 也可以利用滴汞电极上的浓差极化进行极谱分析。 - 9 - §10.2 极化作用
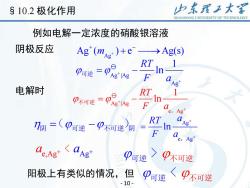
§10.2极化作用 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 例如电解一定浓度的硝酸银溶液 阴极反应 Ag(me)+e→Ag(S) 0a进=p3g F Ag 电解时 a e,Ag RT a 7阴=(可逆一不可逆阴 Ag = e,Ag P可逆〉0不可逆 阳极上有类似的情况,但9可逆〈)不可逆 -10-
例如电解一定浓度的硝酸银溶液 + + Ag Ag ( ) e Ag(s) m − 阴极反应 + ⎯⎯→ + Ag |Ag Ag 1 ln RT F a 可逆 = − + 电解时 Ag |Ag e Ag 1 ln RT F a + + 不可逆 = − , 阴 阴 = − ( ) 可逆 不可逆 Ag e Ag ln RT a F a + + = , e,Ag Ag a + 不可逆 阳极上有类似的情况,但 可逆 < 不可逆 - 10 - §10.2 极化作用
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第十一章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十二章 化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十三章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)A08章 电解质溶液.ppt
- 《物理化学》课程教学资源(A)Ⅱ 物理化学辅导与习题详解(共十四章).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第10章 电解与极化作用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《物理化学》课程教学课件(PPT讲稿)可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)胶体分散系统和大分子溶液.ppt
- 《分析化学》课程教学资源(课件讲稿)1-概论.pdf
- 《物理化学》课程教学课件(PPT讲稿)第九章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程各章习题(含参考答案)第十四章 胶体分散系统和大分子溶液.pdf
- 《物理化学》课程各章习题(含参考答案)第十三章 表面物理化学.pdf
- 《物理化学》课程各章习题(含参考答案)第十二章 化学动力学基础(二).pdf
- 《物理化学》课程各章习题(含参考答案)第十一章 化学动力学基础(一).pdf
- 《物理化学》课程各章习题(含参考答案)第十章 电极极化.pdf
- 《物理化学》课程各章习题(含参考答案)第九章 可逆电池.pdf
- 《物理化学》课程各章习题(含参考答案)第八章 电解质溶液.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十四章 胶体分散系统及大分子溶液.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十三章 表面现象.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十二章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十一章 化学动力学基础(一).pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十章 电解与极化作用.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第九章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第八章 电解质溶液.pdf
- 《高分子化学实验》课程实验指导(讲义)实验五 聚丙烯腈的部分水解反应.doc
- 《高分子化学实验》课程实验指导(讲义)实验四 三聚氰胺甲醛树脂的合成及层压板的制备.doc
- 《高分子化学实验》课程实验指导(讲义)实验三 醋酸乙烯酯的乳液聚合及固含量测定.doc
- 《高分子化学实验》课程实验指导(讲义)实验二 丙烯酰胺溶液聚合及其干燥加工.doc
- 《高分子化学实验》课程实验指导(讲义)实验一 MMA本体聚合.doc
