《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律

第二定律 卡诺定理 摘变的计算 第三定律 PhyChemistry 一 因方修 自由能 热力学关系 执力学天条应用 G的计算 习题课 热力学原理

§2.1自发过程的共同特征 热力学第一定律只能告诉人们一化学反应的能量效 应,但不能解决化学变化的方向和限度问题。 在一定条件下,一化学变化或物理变化能不能自动 发生?能进行到什么程度?这就是过程的方向、限度 问题。 历史上曾有人试图用第一定律中的状态函数0、来判断过 程的方向,其中比较著名的是“Thomson-Berthelot规则 其结论:凡是放热反应都能自动进行;而吸热反应均不能自动 进行。 但研究结果发现,不少吸热反应仍能自动进行。高温下的水 煤气反应C(s)+H,0(g)-→C0(g)+H2(g)就是一例。 2

人类经验说明:自然界中一切变化都是有方向和限 度的,且是自动发生的,称为“自发过程” Spontaneous process。 这些变化过程的决定因素是什么? 如:方向 限度 决定因素 热:高温→低温 温度均匀 温度 电流: 高电势→低电势 电势相同 电势 气体:高压→低压 压力相同 压力 钟摆:动能→热 静止 热功转化 那么决定一切自发过程的方向和限度的共同因素是 什么?这个共同因素既然能判断一切自发过程的方 向和限度,自然也能判断化学反应的方向和限度

一、 自发过程的共同特征 人类经验总结: “功可以自发地全部变为热,但热不可 能全部变为功,而不留任何其它变化”。 一切自发过程都是不可逆过程,而 且他们的不可逆性均可归结为热功转换 过程的不可逆性,因此,他们的方向性都可 用热功转化过程的方向性来表达

§2.2热力学第二定律的经典表述 19世纪初,资本主义工业生产已经很发达,迫切需要解决动力 问题。当时人们已经认识到能量守恒原理,试图制造第一类永动 机已宣告失败,然而人们也认识到能量是可以转换的。于是,人 们就想到空气和大海都含有大量的能量,应该是取之不尽的。 有人计算若从大海中取热做功,使大海温度下降1℃,其能量 可供全世界使用100年.。于是人们围绕这一设想,设计种种 机器,结果都失败了。这个问题的实质可归结为热只能从高温 物体自动传向低温物体,没有温差就取不出热来(即从单一热源 吸热)。 5

Kelvin&Plank.总结这一教训来表述热力学第二定律: “不可能造成这样一种机器,这种机器能够循环 不断地工作,它仅仅从单一热源吸热变为功而没 有任何其它变化。”上述这种机器称为第二类永动机。 热力学第二定律的经典叙述可简化为: “第二类永动机是不可能造成的。” Clausius的表述为: “不可能把热从低温物体传到高温物体而不引 起其它变化。” 6

强调说明: 1.所谓第二类永动机,它是符合能量守恒原理的,即 从第一定律的角度看,它是存在的,它的不存在是 失败教训的总结。 2.关于“不能从单一热源吸热变为功,而没有任何其 它变化”这句话必须完整理解,否则就不符合事实。 例如理想气体定温膨胀△U=0,Q-W,就是从环境中吸热全 部变为功,但体积变大了,压力变小了。 3.“第二类永动机不可能造成”可用来判断过程的方向。 热力学第二定律的提出是起源于热功转化的研究,寻找相 应的热力学函数需从进一步分析热功转化入手热机效率)
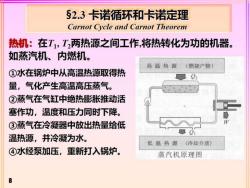
§2.3卡诺循环和卡诺定理 Carnot Cycle and Carnot Theorem 热机:在T,T2两热源之间工作,将热转化为功的机器。 如蒸汽机、内燃机。 高温热源(燃烧产物)》 ①水在锅炉中从高温热源取得热 02 量,气化产生高温高压蒸气。 ②蒸气在气缸中绝热膨胀推动活 塞作功,温度和压力同时下降。 ③蒸气在冷凝器中放出热量给低 温热源,并冷凝为水。 低温热源(冷却介质) ④水经泵加压,重新打入锅炉。 蒸汽机原理图 8
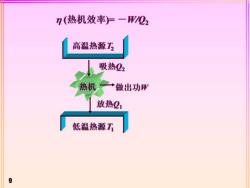
n(热机效率)=一W/Q2 高温热源乃 吸热22 热机一 做出功形 放热21 低温热源T 9
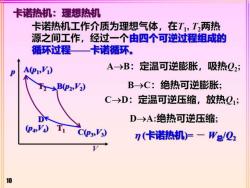
卡诺热机:理想热机 卡诺热机工作介质为理想气体,在T,T2两热 源之间工作,经过一个由四个可逆过程组成的 循环过程—卡诺循环。 A→B: 定温可逆膨胀,吸热Q2; p AP1,) FB(P2,V2) B-→C:绝热可逆膨胀; C→D:定温可逆压缩,放热Q1; D→A:绝热可逆压缩 Cp3,') n(卡诺热机)=一W总/Q2 10
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《高分子化学实验》课程实验指导(讲义)实验一 MMA本体聚合.doc
- 《高分子化学实验》课程实验指导(讲义)实验二 丙烯酰胺溶液聚合及其干燥加工.doc
- 《高分子化学实验》课程实验指导(讲义)实验三 醋酸乙烯酯的乳液聚合及固含量测定.doc
- 《高分子化学实验》课程实验指导(讲义)实验四 三聚氰胺甲醛树脂的合成及层压板的制备.doc
- 《高分子化学实验》课程实验指导(讲义)实验五 聚丙烯腈的部分水解反应.doc
- 《物理化学》课程教学资源(课后复习题及答案)第八章 电解质溶液.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第九章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十章 电解与极化作用.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十一章 化学动力学基础(一).pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十二章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十三章 表面现象.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第十四章 胶体分散系统及大分子溶液.pdf
- 《物理化学》课程各章习题(含参考答案)第八章 电解质溶液.pdf
- 《物理化学》课程各章习题(含参考答案)第九章 可逆电池.pdf
- 《物理化学》课程各章习题(含参考答案)第十章 电极极化.pdf
- 《物理化学》课程各章习题(含参考答案)第十一章 化学动力学基础(一).pdf
- 《物理化学》课程各章习题(含参考答案)第十二章 化学动力学基础(二).pdf
- 《物理化学》课程各章习题(含参考答案)第十三章 表面物理化学.pdf
- 《物理化学》课程各章习题(含参考答案)第十四章 胶体分散系统和大分子溶液.pdf
- 《物理化学》课程教学课件(PPT讲稿)第九章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第9章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第8章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第7章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第5章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第4章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第1章 热力学第一定律.ppt
- 《物理化学》课程教学资源(书籍教材)物理化学简明教程(第四版,高等教育出版社:印永嘉).pdf
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 误差与数据分析.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 络合滴定.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
