《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法

餐山东理工大窖C化学化工学院RSHANDONG UNIVERSITY OFTECHNOLOGY分析化学Analytical Chemistry87R主讲老师联系方式:
1 分析化学 Analytical Chemistry 主讲老师: 联系方式: 1

山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY第7章氧化还原滴定法
2 第7章 氧化还原滴定法 2

山东理工大客7.1.1 概述SHANDONGUNIVERSITYOFTECHNOLOGY1、氧化还原电对(Ox/Red)MnO4/Mn2+如: Zn2+/Zn Fe3+/Fe2+理2、氧化还原半反应Ox+ze-Red注:z为转移的电子数氧化态还原态这里的Ox也可以简称为O,Red可以简称为R
3 1、氧化还原电对( Ox/Red ) 如:Zn2+/Zn Fe3+/Fe2+ MnO4 - /Mn2+ 2、氧化还原半反应 Ox+ze=Red 氧 化 态 还 原 态 注:z为转移的电子数, 这里的Ox也可以简称为 O,Red可以简称为R。 7.1.1 概述 3

山东理工大客SHANDONGUNIVERSITY OFTECHNOLOGY例:铜锌原电池中的氧化还原电对及反应半反应氧化还原电对标准电势-Cu?+ + 2e = Cup= 0.337VCu2+/CuZn2+/ZnZn2+ + 2e = ZnP2 = -0.763V0>p22+2+Cu2+ +Zn = Cu + Zn氧化剂还原剂
4 Cu + e = Cu + 2 2 1 = 0.337V Zn + e = Zn + 2 2 2 = −0.763V + + + = + 2 2 Cu Zn Cu Zn 氧化剂 还原剂 1 2 半反应 Zn2+ /Zn Cu2+ /Cu 氧化还原电对 标准电势 例:铜锌原电池中的氧化还原电对及反应 4
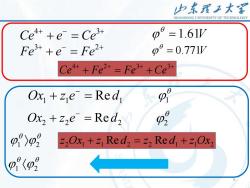
山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGYHCe4+ + e- = Ce3+4-= 1.61VDFe3+ +e' = Fe2+R= 0.771VD4+.3+2+3+=Fe+Fe+CeeOx, + z,e- = RedHOx2 + Zze- = Red2P2z,Ox+z Red,=z,Red, +z,Ox<p20
5 + − + + = 4 3 Ce e Ce = 1.61V + − + + = 3 2 Fe e Fe = 0.771V + + + + + = + 4 2 3 3 Ce Fe Fe Ce 1 1 Re d1 Ox + z e = − 1 2 2 Re 2 Ox + z e = d − 2 1 2 2 1 1 Re 2 2 Re 1 1Ox2 z Ox + z d = z d + z 1 2 5

山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY氧化剂的氧化能力的强弱或还原剂的还原能力的强弱可以用氧化还原电对的电极电势表示a越高,氧化态氧化能力越强,可氧化电势较低的0还原态我0越低,还原态还原能力越强,可可还原电势较高的9氧化态根据电极电势可以判断氧化还原反应的方向,氧化还原反应的实质是电子得失过程!
6 氧化剂的氧化能力的强弱或还原剂的还原能力的强弱 可以用氧化还原电对的电极电势表示 越高,氧化态氧化能力越强,可氧化电势较低的 还原态 越低,还原态还原能力越强,可还原电势较高的 氧化态 根据电极电势可以判断氧化还原反应的方向,氧 化还原反应的实质是电子得失过程! 6

山东理工大客可逆电对一不可逆电对SHANDONGUNIVERSITYOFTECHNOLOGY可逆电对:在反应的任一瞬间,能建立起平衡,电势符合能斯特公式。例如:Fe3+/Fe2+,I/I不可逆电对:不能在反应的任一瞬间建立起平衡,实际电势与理论电势相差较大。以能斯特公式计算的结果仅作参考。例如: Mn04-/Mn2+, Cr20,2-/Cr3+, S,02-/S,032-
7 可逆电对:在反应的任一瞬间,能建立起平衡,电势符 合能斯特公式。 例如: Fe3+ /Fe2+ , I2 /I- 不可逆电对:不能在反应的任一瞬间建立起平衡,实际 电势与理论电势相差较大。以能斯特公式计算的结果, 仅作参考。 例如:MnO4- /Mn2+ ,Cr2O7 2- /Cr3+ ,S4O6 2- /S2O3 2- 可逆电对—不可逆电对 7

山东理工大客对称电对一不对称电对SHANDONGUNIVERSITYOFTECHNOLOGY对称电对:氧化态与还原态的系数相同。例如:Fe3++ e=Fe2+MnO- + 8H+ + 5e = Mn2+ + 4H,0不对称电对:氧化态与还原态系数不同。例如:I+2e=2ICr20,2- + 14H+ + 6e = 2Cr3+ + 7H,0可逆电对不一定就是对称电对,不可逆电对也不一定就是不对称电对!
8 对称电对:氧化态与还原态的系数相同。 例如: Fe3+ + e = Fe2+ MnO4 - + 8H+ + 5e = Mn2+ + 4H2O 可逆电对不一定就是对称电对,不可逆电对也不一 定就是不对称电对! 不对称电对:氧化态与还原态系数不同。 例如: I2 + 2e = 2I - Cr2O7 2- + 14H+ + 6e = 2Cr3+ + 7H2O 对称电对—不对称电对 8

山东理工大客7.1.2 条件电势SHANDONGUNIVERSITYOFTECHNOLOGY能斯特方程和标准电极电势Ox, + zje = Redl0.059dox(25°C)gZdRed注意:1.Z:电对的电子转移数2.Pe:标准电极电势,温度的函数,表示25℃时ao=ar=1 mol/L时的电极电势,Pe可查附录表。3. β随[HI]而改变,随ao和αr而变化
9 1 1 Red1 Ox + z e = 能斯特方程和标准电极电势 (25 C) α α lg z 0.059 Red θ Ox = + 注意: 1. z:电对的电子转移数 2. φθ:标准电极电势,温度的函数,表示t=25℃时, aO=aR=1 mol/L时的电极电势,φθ可查附录表。 3. φ随[H+ ]而改变,随 aO和 aR而变化。 7.1.2 条件电势 9
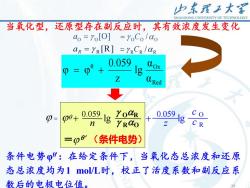
山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY当氧化型,还原型存在副反应时,其有效浓度发生变化α = %[O]1=%oC /αoaR =YR[R] =YRCR /αR0.059doxDgdRed7co0.059YoQR0.059D+lglgCRRαOnZ=β0(条件电势)条件电势:在给定条件下,当氧化态总浓度和还原态总浓度均为1mol/L时,校正了活度系数和副反应系数后的电极电位值。10
10 Red θ Ox α α lg z 0.059 = + 当氧化型,还原型存在副反应时,其有效浓度发生变化 = (条件电势) 0.059 lg 0.059 lg n c O z + + OR RO c R = 条件电势φθ':在给定条件下,当氧化态总浓度和还原 态总浓度均为1 mol/L时,校正了活度系数和副反应系 数后的电极电位值。 O O O aO = O [O] = C / [R] R = aR R R R = C / 10
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《物理化学》课程教学资源(书籍教材)物理化学简明教程(第四版,高等教育出版社:印永嘉).pdf
- 《物理化学》课程教学课件(PPT讲稿)第1章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第4章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第5章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第7章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第8章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第9章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《高分子化学实验》课程实验指导(讲义)实验一 MMA本体聚合.doc
- 《高分子化学实验》课程实验指导(讲义)实验二 丙烯酰胺溶液聚合及其干燥加工.doc
- 《高分子化学实验》课程实验指导(讲义)实验三 醋酸乙烯酯的乳液聚合及固含量测定.doc
- 《高分子化学实验》课程实验指导(讲义)实验四 三聚氰胺甲醛树脂的合成及层压板的制备.doc
- 《高分子化学实验》课程实验指导(讲义)实验五 聚丙烯腈的部分水解反应.doc
- 《物理化学》课程教学资源(课后复习题及答案)第八章 电解质溶液.pdf
- 《物理化学》课程教学资源(课后复习题及答案)第九章 可逆电池的电动势及其应用.pdf
- 《分析化学》课程教学课件(PPT讲稿)第三章 误差与数据分析.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 络合滴定.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)02章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)03章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)04章 多组分系统热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)06章 -化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 误差.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 吸光光度.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 络合滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第二章 酸碱滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 沉淀滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 重量分析.ppt
