《物理化学》课程教学课件(PPT讲稿)06章 -化学平衡

第六章化学平衡范霍夫平衡箱TF32eEdD+eEJF+gGp'pp'EprPo
第六章 化学平衡

第六章化学平衡S6.1化学反应的平衡条件反应进度和化学反应的亲和势S6.2化学反应的平衡常数和等温方程式S6.3平衡常数的表示式86.4复相化学平衡s6.5标准摩尔生成Gibbs自由能86.6温度、压力及惰性气体对化学平衡的影响S6.7同时化学平衡S6.8 反应的耦合S6.9近似计算*S6.10生物能学简介
第六章 化学平衡 §6.1 化学反应的平衡条件—— 反应进度和化学反应的亲和势 §6.2 化学反应的平衡常数和等温方程式 §6.3 平衡常数的表示式 §6.4 复相化学平衡 §6.5 标准摩尔生成Gibbs自由能 §6.6 温度、压力及惰性气体对化学平衡的影响 §6.8 反应的耦合 §6.9 近似计算 §6.7 同时化学平衡 *§6.10 生物能学简介

S 6.1化学反应的平衡条件和反应进度的关系化学反应系统:封闭的单相系统,当发生了不作非膨胀功,一个微小变化时,有:+EugdngdU = TdS- pdV +BZdG =-SdT +Vdp +MgdnBB引入反应进度的概念dnBd=三dnβ = VgdDVB
§6.1 化学反应的平衡条件和反应进度 的关系 化学反应系统: 封闭的单相系统,不作非膨胀功,当发生了 一个微小变化时,有: B B d d d d U T S p V n = − + B B B d d d d G S T V p n = − + + B 引入反应进度的概念 B B d d n = d d nB B =

反应进度(extentofreaction)VD+VeE+...→V.F+V.G+..Np.Neot=0,S=0NeonGot=t,s=sNenGnpNE反应进度的定义为:dnbA5 = ns(5)-no≤ 单位: moldE =VBVBnB.0和 nB 分别代表任一组分B 在起始和 t 时刻的物质的量。VB是任一组分B的化学计量数对生成物取正值。对反应物取负值
反应进度(extent of reaction ) 反应进度 的定义为: B B,0 B n n ( ) = − B B d d n = 和 分别代表任一组分B 在起始和 t 时 刻的物质的量。 是任一组分B的化学计量数, 对反应物取负值,对生成物取正值。 nB,0 B n B D E F G D E F G + +→ + + t = t, = D n E n F n G n t = 0, = 0 nD,0 E,0 n nF,0 nG,0 单位:mol

C的关系化学反应的平衡条件和反应进度基本公式可表示为:ZdU = TdS- pdV +VBlgdEBZdG =-SdT +VdpVBlgdE+B等温、等压条件下,(dG)T,p=μgdng =VBlgdEBB
化学反应的平衡条件和反应进度 的关系 基本公式可表示为: B B B d d d d U T S p V = − + B B B d d d d G S T V p = − + + 等温、等压条件下, , B B B ( )d d G n T p = B B B = d

的关系化学反应的平衡条件和反应进度2(dG)r,=VBHgdEBaG=ZVBlb = △,G,asBJT,P这两个公式适用条件:(1)含等温、等压、不作非膨胀功的一个化学反应(2)反应过程中,各物质的化学势B保持不变
化学反应的平衡条件和反应进度 的关系 , B B B ( )d d G T p = B B r m T p, B G G = = 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势 B 保持不变

判断化学反应的方向与限度aG)T,p,vsug或(A,Gm)T,β作判据都是等效的用05B0B=0(△,Gm)T,p反应达到平衡ZVBllβ = OB
判断化学反应的方向与限度 用 , B r m , 作判据都是等效的 B ( ) , ( ) T p B T p G G 或 r m , ( ) G T p 0 反应自发地向右进行 r m , ( ) 0 G T p 反应自发地向左进行 r m , ( ) 0 G T p = 反应达到平衡 B B B 0 B B B > 0 B B B = 0

判断化学反应的方向与限度aG判断,这相当于 G~用图上曲线的斜率a5T,P反应进度处于0~1mol之间。因为是微小变化,aG0asT,pOG=0反应达到平衡a5JT.P
判断化学反应的方向与限度 用 判断,这相当于 图上曲线的斜率 T p, G G ~ , 0 T p G 反应自发向右进行,趋向平衡 , 0 T p G 反应自发向左进行,趋向平衡 , 0 T p G = 反应达到平衡 因为是微小变化,反应进度处于0~1 mol之间
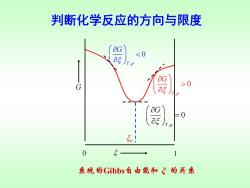
判断化学反应的方向与限度aG<0a5)T.PaGGasaG=0aEJT,PO?系统的Gibbs自由能和三的关系
判断化学反应的方向与限度 , 0 T p G , 0 T p G = , 0 T p G Gibbs ξ 0 1 G e

为什么化学反应通常不能进行到底?严格讲,反应物与产物处于同一系统的反应都不能进行到底,是可逆的,只有逆反应与正反应相比小到可以忽略不计的反应,可以粗略地认为可以进行到底。这主要是由于存在混合Gibbs自由能的缘故
为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一系统的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)04章 多组分系统热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)03章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)02章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 络合滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 误差与数据分析.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《物理化学》课程教学资源(书籍教材)物理化学简明教程(第四版,高等教育出版社:印永嘉).pdf
- 《物理化学》课程教学课件(PPT讲稿)第1章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第4章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 误差.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 吸光光度.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 络合滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第二章 酸碱滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 沉淀滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 重量分析.ppt
- 《分析化学》课程教学课件(PPT讲稿)第四章 氧化还原滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)绪论.ppt
- 《分析化学》课程教学资源(实验指导)水泥中铁、铝含量的测定.doc
- 《分析化学》课程教学资源(实验指导)过氧化氢含量的测定.doc
- 《分析化学》课程教学资源(实验指导)铅、铋含量的测定.doc
- 高等教育出版社:《分析化学》课程教材书籍PDF电子版(武汉大学第5版,共十一章).pdf
- 《分析化学》课程教学资源(课件讲稿)第一章 绪论.pdf
- 《分析化学》课程教学资源(课件讲稿)第三章 误差与数据分析.pdf
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定.pdf
- 《分析化学》课程课后思考题(含答案)第五章 酸碱滴定.doc
- 《分析化学》课程教学资源(课件讲稿)概论 Analytical chemistry.pdf
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
