石河子大学:《分析化学》课程PPT教学课件(药学专业)第六章 氧化还原滴定法

氧化还原滴定法 ●概述 ●氧化还原平衡和反应速室 ●氧化还原滴定曲线 ●氧化还原滴定中的指示剂 ●高锰酸钾法 ●碘量法 ●其他氧化还原滴定法 ●氧化还原滴定法的应用
概述 氧化还原平衡和反应速率 氧化还原滴定曲线 氧化还原滴定中的指示剂 高锰酸钾法 碘量法 其他氧化还原滴定法 氧化还原滴定法的应用 氧化还原滴定法

§1概述 ■氧化还原滴定:是以氧化还原反应为基 础的滴定方法(redox titration)。 氧化还原反应的实质与特点: (1)是电子转移反应 (2)反应常分步进行 (3)反应速率慢,且多有副反应
§1 概 述 ◼ 氧化还原滴定:是以氧化还原反应为基 础的滴定方法(redox titration)。 ◼ 氧化还原反应的实质与特点: (1) 是电子转移反应 (2) 反应常分步进行 (3) 反应速率慢,且多有副反应

常用的氧化还原滴定方法: 高锰酸钾法、碘量法、铈量法、亚硝酸钠法、 溴酸钾法和重铬酸钾法等。 应用范围: (1)可直接测定本身具有氧化还原性的物质 (2)可间接测定能与氧化剂还原剂定量发生 化学反应的物质
◼常用的氧化还原滴定方法: 高锰酸钾法、碘量法、铈量法、亚硝酸钠法、 溴酸钾法和重铬酸钾法等。 ◼应用范围: (1) 可直接测定本身具有氧化还原性的物质 (2)可间接测定能与氧化剂还原剂定量发生 化学反应的物质

§2氧化还原平衡和反应速率 条件电位 在氧化还原反应中,氧化剂或还原剂的氧化还 原能力大小,可用该氧化还原电对的电极电位(简 称电位,用0表示)八。根据电对的大小,也可判断反 应进行的程度和方向。 对半反应ox+ne red,其电极电位可表示 RT oxlred oxlred n nF ox/red为aox-ared-1mol/L时的电极电位即标准电位
§2 氧化还原平衡和反应速率 一、条件电位 在氧化还原反应中,氧化剂或还原剂的氧化还 原能力大小,可用该氧化还原电对的电极电位(简 称电位,用表示)。根据电对的大小,也可判断反 应进行的程度和方向。 对半反应ox + ne red ,其电极电位可表示 为 θ ox/red为aox=ared=1mol/L时的电极电位即标准电位。 red o x a a nF RT o x red o x red / = / + ln

考虑离子强度及氧化态和还原态存在的副 反应两个因素 例如计算HCI溶液中Fe3+/Fe2+体系的电位。 解可化解为: ynare2.C(Fe+) YnrC(Fe2+) 当CFe3+=C(Fe2+)=lmol/L时,得 'Fe2+ FeIFe=peIre+0.059161g P Fe IFe
考虑离子强度及氧化态和还原态存在的副 反应两个因素 例如 计算HCl溶液中Fe3+/ Fe2+体系的电位。 解 可化解为: 当C(Fe3+)= C(Fe2+)=1mol/L时,得 ( ) ( ) 0.05916lg 2 3 / / 2 3 3 2 3 2 3 2 + + + + + + + + = + + + C Fe C Fe F e F e F e F e F e F e Fe Fe + + + + + + + + = + + + = 3 2 2 3 3 2 3 2 3 2 / / / 0.05916lg ' F e F e F e F e F e F e F e F e Fe Fe

条件电位(conditional potential):它是在特定 条件下,氧化态和还原态的总浓度均为 1mol/L时,校正了各种外界因素后的实际电 位。 引入条件电位后,25℃时,能斯特方程式 可表示为: 0.05916, C(ox) Poxlred=P'oxlred n C(red)
条件电位(conditional potential): 它是在特定 条件下,氧化态和还原态的总浓度均为 1mol/L时,校正了各种外界因素后的实际电 位。 引入条件电位后,25℃时,能斯特方程式 可表示为: ( ) ( ) lg 0.05916 ' / / C red C ox n o x red = o x red +

例1计算在1mol/LHC1溶液中,C(Ce4+)=2.00×10-2 mol/L,C(Ce3+片4.00×10-3mol/L时,Ce4+/Ce3+电 对的电位。 解 Ce4+e e3+ Ce4+/Ce3t=1.28V Ce4+Ce3+= Ce4+/Ce3++0.05916lgC(Ce4+)/ C(Ce3+) =1.28+0.059161g2.00×10-2/4.00×10-3 =1.32(V
例1 计算在1mol/LHCl溶液中, C(Ce4+)=2.00×10-2 mol/L,C(Ce3+)=4.00×10-3mol/L时, Ce4+/ Ce3+电 对的电位。 解 Ce4+ + e Ce3+ ‘Ce4+ / Ce3+=1.28V Ce4+ / Ce3+= ‘Ce4+ / Ce3+ +0.05916lg C(Ce4+)/ C(Ce3+) =1.28+0.05916lg2.00 ×10-2 / 4.00×10-3 =1.32(V)

例2计算0.10mol/LHCI溶液中As(V)/As(Ⅲ)电对 的条件电位,忽略离子强度的影响。 解AsO4+2H+2e一H3AsO3+H0 As(V)/As(III)=0.559V 忽略离子强度的影响,条件电位只受酸度的影响 0.05916,[H3AsO4][H+]2 As(V)/As(III)= eAs(V)/As(II) 2 [H,AsO] As(V)/As(III) AS(VAS(II)+0.059161g[H] =0.559-0.05916=0.500V
例2 计算0.10 mol/LHCl溶液中As(Ⅴ)/ As(Ⅲ)电对 的条件电位,忽略离子强度的影响。 解 H3AsO4 + 2H+ +2e H3AsO3 +H2O As(Ⅴ)/ As(Ⅲ) =0.559V 忽略离子强度的影响,条件电位只受酸度的影响 As(Ⅴ)/ As(Ⅲ)= θAs(Ⅴ)/ As(Ⅲ) + As(Ⅴ)/ As(Ⅲ)= θAs(Ⅴ)/ As(Ⅲ) +0.05916lg[H+ ] =0.559-0.05916=0.500(V) [ ] [ ][ ] lg 2 0.05916 3 4 2 3 4 H AsO H AsO H +

二、氧化还原反应的条件平衡常数 一个反应的完全程度可用平衡常数的大小来判断。 如考虑溶液中离子强度和各种副反应的影响,引入条件 电位,求出条件平衡常数K‘,则更能说明实际进行程 度。 ●若用下式代表所发生氧化还原后应 m ox n red2 m ox2 n red ● oX +ne red, ●两电极的电极反应 ox,me red2 ●相应的能斯特方程式是 g=9+0.05916gC。 n 0.05916.C p2=p2+ -g m Cred?
二、氧化还原反应的条件平衡常数 一个反应的完全程度可用平衡常数的大小来判断。 如考虑溶液中离子强度和各种副反应的影响,引入条件 电位,求出条件平衡常数K‘ ,则更能说明实际进行程 度。 若用下式代表所发生氧化还原反应 两电极的电极反应 相应的能斯特方程式是 m ox1 + n red2 m ox2 + n red1 ox1 + n e red1 ox2 + m e red2 2 1 lg ' 0.05916 1 1 red ox C C n = + 2 2 lg ' 0.05916 2 2 red ox C C m = +
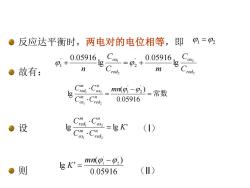
●反应达平衡时,两电对的电位相等,即9=P2 0.05916, Cm=0,+ .05916, ●故有: 2 m C·Ca-nmn0,)=常数 red, 0.05916 0X1 ●设 CrCim=K leChod () ●则 Ig k'=mno-p.) 0.05916 ()
反应达平衡时,两电对的电位相等,即 故有: 设 (I) 则 (II) 2 2 2 1 lg 0.05916 lg 0.05916 ' 2 ' 1 red o x red o x C C C m C n + = + = 常数 − = 0.05916 ( ) lg ' 2 ' 1 1 2 1 2 mn C C C C n red m ox n ox m red lg lg ' 1 2 1 2 K C C C C n red m ox n ox m red = 0.05916 ( ) lg ' 2 ' 1 − = mn K 1 =2
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第四章 酸碱滴定法.pps
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第三章 滴定分析概论.pps
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第二章 误差及分析数据处理.pps
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第一章 绪论(主将教师:赵芳).pps
- 《分析化学》课程教学资源(试卷习题)分析化学试题答案(1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题10(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题8(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题9(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题6(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题5(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题7(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题4(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题3(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题2(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题1(答案见1-10).pdf
- 石河子大学:《分析化学》课程教学实验指导(共十二个实验).doc
- 石河子大学:《分析化学》课程教学资源(授课教案)实验教案讲义.doc
- 石河子大学:《分析化学》课程教学实验指导(共三个实验).doc
- 《分析化学》课程教学资源(作业习题)重量法(无答案).pdf
- 《分析化学》课程教学资源(作业习题)沉淀滴定法(无答案).pdf
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第七章 沉淀滴定.pps
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第一章 概论(主讲:曹红).pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差及数据处理.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第五章酸碱滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第六章 络合滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第七章 氧化还原滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第八章 沉淀滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第九章 重量分析法.pdf
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案01.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案02.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案03.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案04.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案05.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案06.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案07.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案08.doc
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第1章 绪论(主讲:刘子龙).ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第3章 分析化学中的误差及数据处理.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第5章 酸碱平衡及酸碱滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第6章 络合平衡和络合滴定法.ppt
