石河子大学:《分析化学》课程教学资源(课件讲稿)第八章 沉淀滴定法

后酒子大宝 Shihezi University 以沉淀反应为基础的滴定分析法称为沉淀滴定法。 沉淀反应很多,但能用于沉淀滴定的不多。 一,适合沉淀滴定法的沉淀反应必须具备下列条件: 1.生成的沉淀必须有恒定的组成; 2.沉淀必须有足够小的溶解度; 3.沉淀反应必须能定量、迅速地进行; 4.有确定滴定终点的适当方法
以沉淀反应为基础的滴定分析法称为沉淀滴定法。 以沉淀反应为基础的滴定分析法称为沉淀滴定法。 沉淀反应很多,但能用于沉淀滴定的不多。 沉淀反应很多,但能用于沉淀滴定的不多。 一. 适合沉淀滴定法的沉淀反应必须具备下列条件: 适合沉淀滴定法的沉淀反应必须具备下列条件: 1.生成的沉淀必须有恒定的组成; .生成的沉淀必须有恒定的组成; 2. 沉淀必须有足够小的溶解度; 沉淀必须有足够小的溶解度; 3. 沉淀反应必须能定量、迅速地进行; 沉淀反应必须能定量、迅速地进行; 4. 有确定滴定终点的适当方法。 有确定滴定终点的适当方法

后酒子大宝 Shihezi University ■目前应用较广泛的是生成难溶性银盐的反应。 口例如: Ag++X-=AgX ■利用生成难溶性银盐的沉淀滴定法,称为银量法。 ■用该法可以测定CI一、Br-、I-、CN-、SCN-、Ag等
� 目前应用较广泛的是生成难溶性银盐的反应。 目前应用较广泛的是生成难溶性银盐的反应。 � 例如: Ag+ ++ X- = AgX↓ � 利用生成难溶性银盐的沉淀滴定法,称为 利用生成难溶性银盐的沉淀滴定法,称为银量法。 � 用该法可以测定 用该法可以测定Cl-、Br-、I-、CN-、SCN-、Ag++等

酒节大 Shihezi University 二、滴定曲线 0.1000mo/L ARNO3滴定20.00ml同浓度NaCl溶液 Ag+C=AgCI↓ Ksp=[Ag][C]=1.8×10-10 PAg pCI=pAsp
二、滴定曲线 Ag++ + Cl - = AgCl↓ Kspsp= [Ag++ ][Cl -]=1.8×10-10 -10 pAg + pCl = pKspsp 0.1000 mol/L AgNO 0.1000 mol/L AgNO 0.1000 mol/L AgNO 0.1000 mol/L AgNO 0.1000 mol/L AgNO 0.1000 mol/L AgNO 0.1000 mol/L AgNO 0.1000 mol/L AgNO33滴定20.00 ml 20.00 ml 20.00 ml 20.00 ml 20.00 ml 20.00 ml 20.00 ml 20.00 ml 同浓度NaCl 溶液

后酒子大学 Shihezi University 滴定开始前: [C]=0.1000mol/ pC1=1.00 化学计量点前:用未反应的C计算 0.1%:【CH1喇= 0.1000×0.02 =5.0×10-5molL 20.00+19.98 pCl=4.30 pAg=pKp-pC1=9.81-4.30=5.51
滴定开始前: [Cl -] = 0.1000 mol/L ] = 0.1000 mol/L ] = 0.1000 mol/L ] = 0.1000 mol/L ] = 0.1000 mol/L ] = 0.1000 mol/L ] = 0.1000 mol/L ] = 0.1000 mol/L pCl = 1.00 化学计量点前: 化学计量点前: 用未反应的Cl -计算 -0.1%: [Cl -] ((剩)) = = 5.0 = = 5.0 = = 5.0 = = 5.0 = = 5.0 = = 5.0 = = 5.0 = = 5.0 × 10-5-5 mol/L pCl = 4.30 = 4.30 = 4.30 = 4.30 = 4.30 = 4.30 = 4.30 = 4.30 pAg = pKspsp - pCl = 9.81 - 4.30 = 5.51 = 9.81 - 4.30 = 5.51 = 9.81 - 4.30 = 5.51 = 9.81 - 4.30 = 5.51 = 9.81 - 4.30 = 5.51 = 9.81 - 4.30 = 5.51 = 9.81 - 4.30 = 5.51 = 9.81 - 4.30 = 5.51 20.00 19.98 0.1000 0.02 + ×

后酒子大宝 Shihezi University sp: [Ag']=[CH] pC1=pAg=1/2pp=4.89 化学计量点后:根据过量的Ag计算 +01%:Agl-0008-50x10smoM 20.00+20.02 pAg=4.30 pC1=PASp-PAg=9.81-4.30=5.51
sp: [Ag++ ]=[Cl -] pCl = pAg = 1/2 pKspsp = 4.89 化学计量点后: 化学计量点后:根据过量的Ag++计算 + 0.1%:[Ag++ ] ((过)) = = 5.0 = = 5.0 = = 5.0 = = 5.0 = = 5.0 = = 5.0 = = 5.0 = = 5.0 × 10-5-5 mol/L pAg = 4.30 = 4.30 = 4.30 = 4.30 = 4.30 = 4.30 = 4.30 = 4.30 pCl = pKspsp-pAg = 9.81-4.30 = 5.51 = 9.81-4.30 = 5.51 = 9.81-4.30 = 5.51 = 9.81-4.30 = 5.51 = 9.81-4.30 = 5.51 = 9.81-4.30 = 5.51 = 9.81-4.30 = 5.51 = 9.81-4.30 = 5.51 20.00 20.02 0.1000 0.02 + ×

后调子大学 Shihezi University 考虑sp附近,AgC溶解进入溶液的离子: -0.1%: [CH=[C]剩余+[C]溶解 [C】溶解[Ag]=C Kp=[C]IAg]=(IC]剩余+c)c c=2.9×106molL, pC1=4.28, pAg=pKp-pCl=9.81-4.28=5.53
考虑sp附近,AgCl溶解进入溶液的离子: 溶解进入溶液的离子: -0.1%: [Cl -] =[Cl -]剩余+[Cl -]溶解 [Cl -]溶解=[Ag++ ]=c Kspsp=[Cl -][Ag++ ]=([Cl -]剩余+ c) c c= 2.9 × 10-6-6 mol/L, pCl = 4.28, = 4.28, = 4.28, = 4.28, = 4.28, = 4.28, = 4.28, = 4.28, pAg = pKspsp - pCl = 9.81 - 4.28 = 5.53 = 9.81 - 4.28 = 5.53 = 9.81 - 4.28 = 5.53 = 9.81 - 4.28 = 5.53 = 9.81 - 4.28 = 5.53 = 9.81 - 4.28 = 5.53 = 9.81 - 4.28 = 5.53 = 9.81 - 4.28 = 5.53
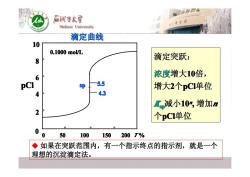
后酒子大 Shihezi University 滴定曲线 10 0.1000mo/L 滴定突跃: 8 6 浓度增大10倍, PCI sp 5.5 增大2个pC1单位 4 43 L减小10%,增加n 2 个pCI单位 0 0 50 100 150 200T% ◆如果在突跃范围内,有一个指示终点的指示剂,就是一个 理想的沉淀滴定法
0 50 100 150 200 0 50 100 150 200 0 50 100 150 200 0 50 100 150 200 0 50 100 150 200 0 50 100 150 200 0 50 100 150 200 0 50 100 150 200 T % pCl 0.1000 mol/L 0.1000 mol/L 0.1000 mol/L 0.1000 mol/L 0.1000 mol/L 0.1000 mol/L 0.1000 mol/L 0.1000 mol/L 5.5 4.3 0 2 4 6 8 10 sp 滴定曲线 滴定突跃: 浓度增大10倍, 增大2个pCl单位 Kspsp减小10nn , 增加n 个pCl单位 � 如果在突跃范围内,有一个指示终点的指示剂,就是一个 如果在突跃范围内,有一个指示终点的指示剂,就是一个 理想的沉淀滴定法。 理想的沉淀滴定法

后酒子大学 Shihezi University 三.银量法的原理及应用 指示剂: K2CrOa 莫尔法 铁氨矾NHFe(SO)◆ 佛尔哈德法 吸附指示剂 法扬司法
指示剂: K22CrO44 � 莫尔法 铁氨矾(NH44Fe(SO44) 22) � 佛尔哈德法 吸附指示剂 � 法扬司法 三. 银量法的原理及应用 银量法的原理及应用

后酒子大 Shihezi University 1.莫尔法Mohr) 滴定反应:Ag十X午AgX↓ 滴定剂:AgNO3标准溶液 待测物:Br、Cl 指示剂:KzCr04 指示原理:Cr042+Ag与Ag2Cr0↓Kp1.10×1012 滴定条件:pH6.5-10.0(或7.2)
指示原理: CrO44 2-2-+ Ag++�Ag22CrO44� Kspsp= 1.10 × 10-12 -12 指示剂:K22CrO44 滴定反应:Ag++ + X- � AgX � 滴定剂:AgNO33标准溶液 待测物:Br- -、Cl - 滴定条件:pH 6.5 pH 6.5 pH 6.5 pH 6.5 pH 6.5 pH 6.5 pH 6.5 pH 6.5-10.0(或7.2) 1. 莫尔法(Mohr)

后调子大学 Shihezi University 指示剂用量 sp时,[Ag]=C]=PXAECD=1.34X10-5molL [CrO-]AgzCro/Ag'P=1.1X102 mol/L 实验确定:浓度一5×103mo/L Cr02太大,终点提前,Cr042黄色干扰 CrO2太小,终点滯后
实验确定: 浓度 -5×10-3-3 mol/L 指示剂用量 sp时, [Ag++ ]=[Cl -]=Ksp(AgCl) sp(AgCl) sp(AgCl) sp(AgCl) sp(AgCl) sp(AgCl) sp(AgCl) sp(AgCl) 1/2 1/2=1.34×10-5-5 mol/L [CrO44 2-2-]=Ksp(Ag sp(Ag 22CrO CrO44 ))/[Ag++ ] 2 2=1.1×10-2-2 mol/L CrO44 2- 2-太大,终点提前, 太大,终点提前, CrO44 2-2-黄色干扰 CrO44 2- 2-太小,终点滞后 太小,终点滞后
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第七章 氧化还原滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第六章 络合滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第五章酸碱滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差及数据处理.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第一章 概论(主讲:曹红).pdf
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第七章 沉淀滴定.pps
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第六章 氧化还原滴定法.pps
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第四章 酸碱滴定法.pps
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第三章 滴定分析概论.pps
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第二章 误差及分析数据处理.pps
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第一章 绪论(主将教师:赵芳).pps
- 《分析化学》课程教学资源(试卷习题)分析化学试题答案(1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题10(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题8(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题9(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题6(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题5(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题7(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题4(答案见1-10).pdf
- 《分析化学》课程教学资源(试卷习题)分化化学试题3(答案见1-10).pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第九章 重量分析法.pdf
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案01.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案02.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案03.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案04.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案05.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案06.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案07.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案08.doc
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第1章 绪论(主讲:刘子龙).ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第3章 分析化学中的误差及数据处理.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第5章 酸碱平衡及酸碱滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第6章 络合平衡和络合滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第7章 氧化还原滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第8章 沉淀滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第9章 重量分析法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第一章 绪论 Analytical Chemistry(主讲:刘子龙).ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第二章 误差和数据处理.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第三章 滴定分析法概论 An introduction to titrimetric analysis.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第四章 酸碱滴定法.ppt
