武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第7章 氧化还原滴定法

式溪享化学与分子科学学院 WUHAN UNIVERSITY 第7章氧化还原滴定法 7.1氧化还原反应及平衡 7.2氧化还原滴定基本原理 7.3氧化还原滴定中的预处理 7.4常用的氧化还原滴定法 7.5氧化还原滴定结果的计算 @或溪大等 Wuhan University
第7章 氧化还原滴定法 7.1 氧化还原反应及平衡 7.2 氧化还原滴定基本原理 7.3 氧化还原滴定中的预处理 7.4 常用的氧化还原滴定法 7.5 氧化还原滴定结果的计算

7.1氧化还原平衡 式溪享化学与分子科学学院 COLLEGE OF CHEMIS TRY RND MOLECULRR SCIENCES WUHRN UNIVERSITY 1概述 aOx+ne=bRed 氧化还原:得失电子,电子转移 反应机理比较复杂,常伴有副反应 控制反应条件,保证反应定量进行, 满足滴定要求 Wuhan University
1 概 述 氧化还原:得失电子, 电子转移 反应机理比较复杂,常伴有副反应 控制反应条件,保证反应定量进行, 满足滴定要求 7.1 氧化还原平衡 aOx+ne=bRed

氧化还原电对 劣溪永享化学与分子科学学院 COLLESE OF CHEMIS TRY AND MOLECULRR SCIENCES WUHAN UNIVERSITY 可逆电对:任一瞬间都能建立平衡,电势可用能斯特 方程描述。Fe3tFe2+,等 不可逆电对:Cr20,2-/Cr3+,Mn04/Mn2+等, 达到平衡时也能用能斯特方程描述电势 对称电对:氧化态和还原态的系数相同 Fe3+/Fe2+,MnO/Mn2+ 不对称电对:Cr2022/Cr3+,/M等 或溪大享 Wuhan University
氧化还原电对 对称电对:氧化态和还原态的系数相同 Fe3+/Fe2+ ,MnO4 - /Mn2+ 等 不对称电对:Cr2O7 2- /Cr3+, I2 /I- 等 可逆电对:任一瞬间都能建立平衡,电势可用能斯特 方程描述。Fe3+/Fe2+ , I2 /I- 等 不可逆电对:Cr2O7 2- /Cr3+, MnO4 - /Mn2+ 等, 达到平衡时也能用能斯特方程描述电势

2条件电势 式溪享化学与分子科学学院 COLLEGE OF CHEMISTRY RND MOLECULRR SCIENCES WUHRN WNIVERSITY 能斯特方程 aOx+ne=bRed a ox 电势EMR=E9±2.30gCR nF 氧化还原反应 Ox+Red2=Red+Ox2 由电对电势EOx/Red2大小判断反应的方向 或溪大享 Wuhan University
2 条件电势 氧化还原反应 Ox1 + Red2 = Red1+Ox2 由电对电势EOx/Red大小判断反应的方向 电对电势 能斯特方程 a b Red nF 2.303RT E lg Ox/Red = E + a a Ox aOx+ne=bRed

式溪*享化学与分子科学学院 COLLEGE OF CHEMIS TRY AND MOLECULRR SCIENCES WUHAN UNIVERSITY 条件电势:特定条件下,cox=ced=1molL1或浓度 比为1时电对的实际电势,用E9反应了离子强度及各 种副反应影响的总结果,与介质条件和温度有关。 描述电对电势与氧化还原态的分析浓度的关系 或溪来享 Wuhan University
描述电对电势与氧化还原态的分析浓度的关系 条件电势:特定条件下,cOx=cRed= 1mol·L-1 或浓度 比为1时电对的实际电势,用E 反应了离子强度及各 种副反应影响的总结果,与介质条件和温度有关

式溪*享化学与分子科学学院 COLLEGE OF CHEMISTRY RND MDLECULRR SCIENCES WUHRN UNIVERSITY Cox/Red=Eo+2305kIg dod nF dox =[Ox]Yox =COx'Y ox /aox aRed-[Red]YRed =CRed'Y Red/ORed 0.059 Y Ox ORed 0.059 E-E8+ C Ox n g + YReda Ox lg c Red =E8(条件电势) 或溪大享 Wuhan University
aOx =[Ox] Ox =cOx· Ox /Ox aRed=[Red] Red =cRed· Red /Red =E (条件电势) 0.059 lg 0.059 lg n c Ox n E=E + + OxRed Red Ox c Red a b Red nF 2.303RT E lg Ox/Red = E + a a Ox

式溪*享化学与分子科学学院 影响条件电势的因素 COLLESE OF CHEMIS TRY AND MOLECULRR SCIENCES WUHAN UNIVERSITY E=E9+0 .059 YOxORed n IgyRed Ox >离子强度 >酸效应 >络合效应 >沉淀 ⊙或浅字 Wuhan University
影响条件电势的因素 0.059 lg n E =E + OxRed Red Ox ➢ 离子强度 ➢ 酸效应 ➢ 络合效应 ➢ 沉淀
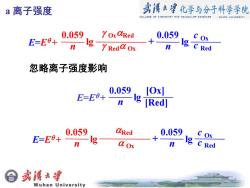
a离子强度 劣溪*享化学与分子科学学院 COLLESE OF CHEMISTRY RND MDLECULRR SCIENCES WUHRN UNIVERSITY 0.059 YOx ORed E=E8+ + 0.059 c Ox n Ig yRedd Ox n g C Red 忽略离子强度影响 0.059 E=E9+ [Ox] n g [Red] 0.059 CRed 0.059. E=E8+ C Ox n lg a Ox nge Red 会 或溪大享 Wuhan University
a 离子强度 0.059 lg 0.059 lg n c Ox n E=E + + OxRed Red Ox c Red 忽略离子强度影响 0.059 lg [Ox] n E=E + [Red] 0.059 lg 0.059 lg n c Ox n E=E + + Red Ox c Red

式溪*享化学与分子科学学院 b酸效应 COLLESE OF CHEMIS TRY AND MOLECULRR SCIENCES H]或O参加氧化还原反应中,影响氧化还原 态物质的分布情况,并直接出现在能斯特方程中, 影响电势值。 c生成络合物 氧化态形成的络合物更稳定,使电势降低,还 原性增加,反之则电势升高,氧化性增加 d生成沉淀 氧化态生成沉淀,使电势降低,还原性增加 还原态生成沉淀,则电势升高,氧化性增加 或溪大等 Wuhan University
b 酸效应 [H+ ]或[OH- ] 参加氧化还原反应中,影响氧化还原 态物质的分布情况,并直接出现在能斯特方程中, 影响电势值。 c 生成络合物 氧化态形成的络合物更稳定,使电势降低,还 原性增加,反之则电势升高,氧化性增加 d 生成沉淀 氧化态生成沉淀,使电势降低,还原性增加 还原态生成沉淀,则电势升高,氧化性增加

3氧化还原反应平衡常数 劣溪大享化学与分子科学学院 COLLEGE OF CHEMIS TRY RND MDLECULRR SCIENCES WUHRN UNIVERSITY p2Ox1+piRed2=p2Redi+p1Ox2 K- CRed2 Cox1 Ox1+me-Red E1-E+0.0591g Cox1 n CRed1 Ox2+nze-Redz E2-E2+ 0.059g COx2 CRed2 或溪未享 Wuhan University
3 氧化还原反应平衡常数 p2Ox1+p1Red2=p2Red1+p1Ox2 Ox1 + n1e = Red1 E1= E1 + Ox2 + n2e = Red2 E2= E2 + 0.059 n1 lg cOx1 cRed1 0.059 n2 lg cOx2 cRed2 cRed1 cOx1 cOx2 cRed2 p1 p1 p2 p2 K =
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第6章 络合平衡和络合滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第5章 酸碱平衡及酸碱滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第3章 分析化学中的误差及数据处理.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第1章 绪论(主讲:刘子龙).ppt
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案08.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案07.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案06.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案05.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案04.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案03.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案02.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案01.doc
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第九章 重量分析法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第八章 沉淀滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第七章 氧化还原滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第六章 络合滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第五章酸碱滴定法.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差及数据处理.pdf
- 石河子大学:《分析化学》课程教学资源(课件讲稿)第一章 概论(主讲:曹红).pdf
- 石河子大学:《分析化学》课程PPT教学课件(药学专业)第七章 沉淀滴定.pps
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第8章 沉淀滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第9章 重量分析法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第一章 绪论 Analytical Chemistry(主讲:刘子龙).ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第二章 误差和数据处理.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第三章 滴定分析法概论 An introduction to titrimetric analysis.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第四章 酸碱滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第五章 配位滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第六章 氧化还原滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第七章 沉淀滴定法和重量分析法.ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)第一章 绪论、第四章 误差与实验数据的处理(主讲:陈思羽).ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)酸碱滴定法的基本原理、多元酸(碱)的滴定、络合滴定法(配位滴定).ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)络合滴定指示剂、配位滴定条件的选择、氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)第九章 沉淀滴定法、第十章 沉淀重量分析法.ppt
- 《分析化学》课程教材:《分析化学》书籍PDF电子版(武汉大学,第四版).pdf
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)第五章 化学平衡与滴定分析法概论、第六章 酸碱滴定法.pptx
- 《物理化学》课程教学资源(PPT课件讲稿)绪论.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第四章 相平衡.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第七章 化学平衡.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第八章 化学动力学基础.ppt
