武汉大学:《分析化学》课程PPT教学课件(化工专业)第七章 沉淀滴定法和重量分析法

第七章 沉淀滴定法和重量分析法 化学分析 1.概述 2.沉淀滴定法 3.重量分析法 4.小结
化学分析 第七章 沉淀滴定法和重量分析法 1. 概述 3. 重量分析法 4. 小 结 2. 沉淀滴定法

第七章 沉淀滴定法和重量分析法 化学分析 1.概述 >定义:以沉淀反应为基础的定量分析方法。 tT+aA T+Ag oh W 沉淀滴定法 重量分析法 >沉淀反应的条件: K。小; 确定的化学计量关系; 沉淀迅速; 有合适的指示剂确定滴定终点
化学分析 第七章 沉淀滴定法和重量分析法 ➢ 定义: 以沉淀反应为基础的定量分析方法。 t T + a A TtAa cTVT w 沉淀滴定法 重量分析法 1. 概述 ➢ 沉淀反应的条件: Ksp 小; 确定的化学计量关系; 沉淀迅速; 有合适的指示剂确定滴定终点

第七章 沉淀滴定法和重量分析法 化学分析 1.概述 两类 沉淀滴定法(precipitation titration) 以沉淀反应为基础的滴定分析方法。 重量分析法(gravimetric analysis) 通过称量物质的质量确定被测组分含量。 包含分离与称量两个过程。 分离:沉淀法、萃取法等。 挥发法、萃取法和沉淀法的操作与理论
化学分析 第七章 沉淀滴定法和重量分析法 两类 ➢ 沉淀滴定法(precipitation titration) 以沉淀反应为基础的滴定分析方法。 ➢ 重量分析法(gravimetric analysis) 通过称量物质的质量确定被测组分含量。 包含分离与称量两个过程。 分离:沉淀法、萃取法等。 挥发法、萃取法和沉淀法的操作与理论。 1. 概述

第七章 沉淀滴定法和重量分析法 化学分析 2.沉淀滴定法 容量沉淀法(volumetric precipitation method) 必需的条件: (1)确定的化学计量关系。 (2)迅速完成,并很快达到平衡。 (3)有适当的方法指示化学计量点。 (4④)沉淀溶解度必须足够小。 目前应用最多的沉淀滴定法是银量法(argent imetry). Ag+X→AgX↓ 式中,X为CI、Br、I或SCN,利用银量法可以测定CI、Br、I厂、 Ag及SCN
化学分析 第七章 沉淀滴定法和重量分析法 容量沉淀法(volumetric precipitation method) 必需的条件: (1) 确定的化学计量关系。 (2) 迅速完成,并很快达到平衡。 (3) 有适当的方法指示化学计量点。 (4) 沉淀溶解度必须足够小。 目前应用最多的沉淀滴定法是银量法 (argentimetry) Ag+ +X - →AgX↓ 式中,X -为Cl-、Br-、I -或SCN-,利用银量法可以测定Cl-、Br-、I -、 Ag+及SCN-。 2. 沉淀滴定法

第七章 沉淀滴定法和重量分析法 化学分析 2.1银量法的基本原理 2.1.1滴定曲线 以AgN03溶液(0.1000mol/L)滴定20.00 mL NaCli溶液 (0.1000mo1/L)为例,计算滴定过程中Ag或C1-浓度的变化, 绘出滴定曲线。 (1)通过溶液中剩余的CI~浓度和AgCI的溶度积计算[Ag]。 例如,加入AgNO3溶液18.00mL时,溶液中氯离子浓度 (mol/L)为 [CI]= 0.1000×2.00 =5.26×10-3 pCl=2.28 20.00+18.00
化学分析 第七章 沉淀滴定法和重量分析法 2.1.1 滴定曲线 以AgNO3溶液 (0.1000mol/L) 滴定20.00mL NaCl溶液 (0.1000mol/L)为例,计算滴定过程中Ag+或Cl-浓度的变化, 绘出滴定曲线。 (1) 通过溶液中剩余的Cl-浓度和AgCl的溶度积计算[Ag+ ]。 例如,加入AgNO3溶液18.00mL时,溶液中氯离子浓度 (mol/L)为 5.26 10 pCl 2.28 20.00 18.00 0.1000 2.00 [Cl ] 3 = = + = − − 2.1 银量法的基本原理

第七章 沉淀滴定法和重量分析法 化学分析 2.1银量法的基本原理 2.1.1滴定曲线 而Ag浓度则因为[Ag][C]=K。=1.8X10-10则 pAg pCI=-Igksp 9.74 故 pAg=9.74-2.28=7.46 同理,当加入AgN03溶液19.98mL时,溶液中剩余的C 浓度(mol/L)为 [C1-]=5.0×10-5 pC=4.30 pAg=5.51
化学分析 第七章 沉淀滴定法和重量分析法 而Ag+浓度则因为[Ag+][Cl- ] = Ksp = 1.8×10-10 则 pAg + pCl= -lgKsp = 9. 74 故 pAg = 9. 74-2.28 = 7.46 同理,当加入AgNO3 溶液19.98mL时,溶液中剩余的Cl- 浓度(mol/L)为 [Cl- ]=5.0×10-5 pCl =4.30 pAg = 5.51 2.1 银量法的基本原理 2.1.1 滴定曲线

第七章 沉淀滴定法和重量分析法 化学分析 2.1银量法的基本原理 2.1.1滴定曲线 (1)滴定开始至化学计量点前 (2)化学计量点时,溶液是AgCI的饱和溶液 PAg=pCI-PK-4.87 (3)化学计量点后,由过量AgNO3的量决定 例如,加入AgN03溶液20.02mL时(过量0.02mlL) 0.1000×0.02 [Ag*]= 20.00+20.02 =5.0×10 pAg=4.30 pC1=9.74-4.30=5.44
化学分析 第七章 沉淀滴定法和重量分析法 5.0 10 pAg 4.30 20.00 20.02 0.1000 0.02 [Ag ] 5 = = + = + − (3) 化学计量点后,由过量AgNO3的量决定 例如,加入AgNO3溶液20.02mL时(过量0.02mL) pCl = 9.74-4.30 = 5.44 2.1 银量法的基本原理 2.1.1 滴定曲线 (1) 滴定开始至化学计量点前 (2) 化学计量点时,溶液是AgCl的饱和溶液 sp 1 pAg pCl p 4.87 2 = = = K
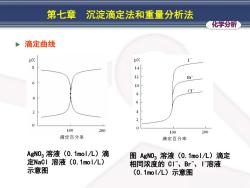
第七章 沉淀滴定法和重量分析法 化学分析 滴定曲线 pX pX Br 6 10 8 6 2 100 200 100 200 滴定百分率 滴定百分率 AgN03溶液(0.1mol/L)滴 图AgN03溶液(0.1mol/L)滴定 定NaCl溶液(0.1mol/L) 相同浓度的C、Br、I溶液 示意图 (0.1mol/八)示意图
化学分析 第七章 沉淀滴定法和重量分析法 滴定曲线 AgNO3 溶液(0.1mol/L)滴 定NaCl 溶液(0.1mol/L) 示意图 图 AgNO3 溶液(0.1mol/L)滴定 相同浓度的 Cl-、Br-、I -溶液 (0.1mol/L)示意图

第七章 沉淀滴定法和重量分析法 化学分析 由滴定曲线可以说明以下几点: >滴定曲线在化学计量点的附近形成滴定突跃。 突跃范围大小取决于沉淀的溶度积常数K。和溶 液浓度c。 100 200 滴定百分率 2.1.2分步滴定 CI厂、Br、I-可根据AgI、AgBr、 AgC1溶度积常数K。的差别进行分步滴定。 8 6 4 100 200 滴定百分率
化学分析 第七章 沉淀滴定法和重量分析法 由滴定曲线可以说明以下几点: ➢ 滴定曲线在化学计量点的附近形成滴定突跃。 ➢ 突跃范围大小取决于沉淀的溶度积常数Ksp 和溶 液浓度c。 2.1.2 分步滴定 Cl-、Br-、I - 可根据AgI、AgBr、 AgCl溶度积常数Ksp 的差别进行分步滴定

第七章 沉淀滴定法和重量分析法 化学分析 2.2银量法终点的指示方法 铬酸钾指示剂法(Mohr法) >铁铵钒指示剂法(Volhard法) 吸附指示剂法(Fajans法) 2.2.1铬酸钾指示剂法 (1)滴定原理 K,CrO,为指示剂,AgNO,液滴定CI和Br sp前:Ag+CI→AgC1↓(白色)Km=1.8×1010 sp:2Ag+Cr0→Ag2CrO4↓Km=1.2×1012 (砖红色)
化学分析 第七章 沉淀滴定法和重量分析法 K CrO 2 4 2.2 银量法终点的指示方法 铬酸钾指示剂法(Mohr 法) 铁铵钒指示剂法(Volhard 法) 吸附指示剂法(Fajans 法) 10 sp sp Ag Cl AgCl 1.8 10 K + − − 前 白色 : ( ) + → = 2- 12 4 2 4 sp sp 2Ag CrO Ag CrO 1.2 10 K + − : + → = (砖红色) 为指示剂, 2.2.1 铬酸钾指示剂法 (1) 滴定原理 AgNO Cl Br 3 液滴定 - - 和
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第六章 氧化还原滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第五章 配位滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第四章 酸碱滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第三章 滴定分析法概论 An introduction to titrimetric analysis.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第二章 误差和数据处理.ppt
- 武汉大学:《分析化学》课程PPT教学课件(化工专业)第一章 绪论 Analytical Chemistry(主讲:刘子龙).ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第9章 重量分析法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第8章 沉淀滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第7章 氧化还原滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第6章 络合平衡和络合滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第5章 酸碱平衡及酸碱滴定法.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第3章 分析化学中的误差及数据处理.ppt
- 武汉大学:《分析化学》课程PPT教学课件(定量分析化学)第1章 绪论(主讲:刘子龙).ppt
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案08.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案07.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案06.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案05.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案04.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案03.doc
- 石河子大学:《分析化学》课程教学资源(电子教案)分析化学电子教案02.doc
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)第一章 绪论、第四章 误差与实验数据的处理(主讲:陈思羽).ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)酸碱滴定法的基本原理、多元酸(碱)的滴定、络合滴定法(配位滴定).ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)络合滴定指示剂、配位滴定条件的选择、氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)第九章 沉淀滴定法、第十章 沉淀重量分析法.ppt
- 《分析化学》课程教材:《分析化学》书籍PDF电子版(武汉大学,第四版).pdf
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)第五章 化学平衡与滴定分析法概论、第六章 酸碱滴定法.pptx
- 《物理化学》课程教学资源(PPT课件讲稿)绪论.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第四章 相平衡.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第七章 化学平衡.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第八章 化学动力学基础.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第一章 热力学第一定律及其应用.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第三章 溶液.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第五章 界面现象.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第六章 胶体分散体系和大分子溶液.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)绪论.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第一章 原子、分子及元素周期性.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第六章 P区元素.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第七章 d区过渡元素(配位化合物).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第九章 d区过渡元素(有机金属化合物、簇合物).ppt
