《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡 Chemical Equilibrium

第四章化学平衡Chapter 4 ChemicalEquilibriumS4.1化学反应的方向和限度一、化学反应的限度二、反应系统的Gibbs自由能三、化学反应的平衡常数和等温方程
1 §4.1 化学反应的方向和限度 一、化学反应的限度 二、反应系统的Gibbs 自由能 三、化学反应的平衡常数和等温方程 第四章 化学平衡 Chapter 4 Chemical Equilibrium

AnB一、化学反应的限度forwardProducts反应:Reactantsbackward当反应达到平衡态时,具有下列特征:1.系统中各物质的数量不再随时间而改变。即反应进度达到极限值一el(反应的限度)。2.宏观上看反应停止了,实际上达到动态平衡。rate(forward)=rate(backward)3.平衡不受催化剂的影响4.反应条件不仅能影响平衡,还能改变反应方向如:加压能使石墨一→金刚石2
2 一、化学反应的限度 反应: Reactants Products 当反应达到平衡态时,具有下列特征: 1.系统中各物质的数量不再随时间而改变。即反应 进度达到极限值— eq(反应的限度)。 2.宏观上看反应停止了,实际上达到动态平衡。 rate(forward)= rate(backward) 3.平衡不受催化剂的影响 4.反应条件不仅能影响平衡,还能改变反应方向。 如:加压能使石墨→金刚石 forward backward , 0 d e f B B B B B n n n − = =

二、反应系统的Gibbs自由能任意化学反应:()rp,W"=0时,反应方向和限度的判据为:(dG)T=μdn=VBd≤ 0其中d为反应的进度。d=dnB/VB【0逆向自发反应系统的吉布斯自由能G如何随=变化呢?3
3 二、反应系统的Gibbs 自由能 , B B T p G = 反应系统的吉布斯自由能G 如何随 变化呢 ? 任意化学反应:( )T, p , W’=0时, 反应方向和限 度的判据为: (dG)T, p = B dnB = B B d 0 其中 d 为反应的进度。 d =dnB /vB 上式可整理为 0 逆向自发
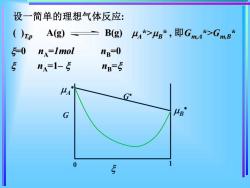
设一简单的理想气体反应:光A(g) B(g)UA*>μB*,即GmA*>G()T,p5m.Am.B5-0np=0n =lmolSn=sna=1- MAUBG0HS
设一简单的理想气体反应: =0 nA =1mol nB=0 nA=1– nB = ( )T,p A(g) B(g) A *>B * , 即Gm,A*>Gm,B * G G 0 1 A B
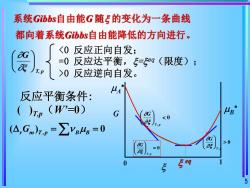
系统Gibbs自由能G随=的变化为一条曲线都向着系统Gibbs自由能降低的方向进行。0反应逆向自发。美A反应平衡条件:( )Tp (W'=0)μBGaG0aGas0=aseqS5
5 反应平衡条件: ( )T,p(W’=0) T, p ξ G , ( ) 0 = = r m T p B B G 系统Gibbs自由能G 随 的变化为一条曲线 都向着系统Gibbs自由能降低的方向进行。 0 反应逆向自发。 G 0 eq 1 A B 0 , T p G 0 , = T p G 0 , T p G

三、化学反应的平衡常数和等温方程假设有理想气体化学反应aA+bB3二gG+hH当反应达到平衡(A,Gm)r,p =VBμg = 0gu+huH=aua+buB混合理想气体的化学势表达式为:Ppμp(T,p)= μ(T)+ RTInDo则上式可写为PGDgue+gRTIn+hμ +hRTInDaμ% +aRT In+bug+bRT In6
6 三、化学反应的平衡常数和等温方程 假设有理想气体化学反应 aA + bB gG + hH 当反应达到平衡 G H A B g h a b + = +B B B ( , ) ( ) ln p T p T RT p = + 混合理想气体的化学势表达式为: 则上式可写为 ln ln ln ln G H G H A B A B p p g gRT h hRT p p p p a aRT b bRT p p + + + = + + + , ( ) 0 = = r m T p B B G

即DIn(gue+hun-aua-bug)RT(分)()式中,PB为B物质在平衡时的分压。=常数=K0()标准平衡常数,一定温度时为一定值,量纲为1
7 即 1 ln ( ) g h G H a b G H A B A B p p p p g h a b p p RT p p = − + − − 式中,pB为B物质在平衡时的分压。 g h G H a b A B p p p p p p p p = 常数 = Kθ 标准平衡常数,一定温度 时为一定值,量纲为1

D0(gue+hun-aua-bug)InRT()()如果令gu+hu-au%-bug=A,Gm则反应的标准吉布斯函数变化,指反应物和产物均处于标准态时,产物△,G =-RTlnK6的吉布斯函数与反应物的吉布斯函数总之差8
8 如果令 1 ln ( ) g h G H a b G H A B A B p p p p g h a b p p RT p p = − + − − G H A B r m g h a b G + − − = 则 ln r m G RT K = − 反应的标准吉布斯函数 变化,指反应物和产物 均处于标准态时,产物 的吉布斯函数与反应物 的吉布斯函数总之差
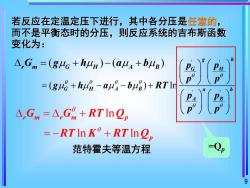
若反应在定温定压下进行,其中各分压是任意的而不是平衡态时的分压,则反应系统的吉布斯函数变化为:A,Gm=(guG+hu)-(au+buB)=(gu+hug-au-bu)+RTlrA,Gm=△,Gm + RT lnQ,=-RTIn K'+RTInQ=Qp范特霍夫等温方程07
9 若反应在定温定压下进行,其中各分压是任意的, 而不是平衡态时的分压,则反应系统的吉布斯函数 变化为: ( ) ( ) = + − + r m G H A B G g h a b ' ' ' ' ( ) ln g h G H G H A B a b A B p p p p g h a b RT p p p p = + − − + ln ln ln r m r m p p G G RT Q RT K RT Q = + = − + 范特霍夫等温方程 =Qp

说明:(1)式中p指平衡分压,P指任意状态时的分压K是标准平衡常数,Q,不是平衡常数,称为“分压商”。(2)推广到任意化学反应,只需用aB代替pB/poA,G. =△,G" +RTInQ.活度商=K0II(ab),IIasD:=Q(aa)e,(ag )enBB理想气体,a表示比值p/po高压实际气体,aB表示比值fB/p0理想液态混合物,B表示浓度xB10
10 说明:(1)式中pB指平衡分压,pB ’指任意状态时的分压; Kθ是标准平衡常数,Qp不是平衡常数,称为“分压商”。 (2)推广到任意化学反应,只需用aB代替pB /pθ ln r m r m a G G RT Q = + 活度商 ( ) B B eq B a K = ( ) ( ) ( ) ( ) b B eq a A eq h H eq g G eq a a a a = B B a B a Q = ☞理想气体, aB表示比值pB/pθ ☞高压实际气体, aB表示比值fB/pθ ☞理想液态混合物, aB表示浓度xB
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 山东理工大学:《物理化学》课程考核大纲.pdf
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《分析化学》课程教学资源(课件讲稿)概论 Analytical chemistry.pdf
- 《分析化学》课程课后思考题(含答案)第五章 酸碱滴定.doc
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定.pdf
- 《分析化学》课程教学资源(课件讲稿)第三章 误差与数据分析.pdf
- 《分析化学》课程教学资源(课件讲稿)第一章 绪论.pdf
- 高等教育出版社:《分析化学》课程教材书籍PDF电子版(武汉大学第5版,共十一章).pdf
- 《分析化学》课程教学资源(实验指导)铅、铋含量的测定.doc
- 《分析化学》课程教学资源(实验指导)过氧化氢含量的测定.doc
- 《分析化学》课程教学资源(实验指导)水泥中铁、铝含量的测定.doc
- 《分析化学》课程教学课件(PPT讲稿)绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)第四章 氧化还原滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 重量分析.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 沉淀滴定.ppt
- 《有机与药物合成化学》课程教学资源(书籍文献)化学ABC.pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)化学ABC之pH和pKa.pdf
- 山东理工大学:《物理化学》课程教学课件(讲稿)第11章 化学动力学基础(一).pdf
- 《物理化学》课程教学课件(PPT讲稿)A11章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)A14章 胶体与大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)A08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)A09章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)A10章 电解与极化作用.ppt
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A05章 化学平衡.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A06章 相平衡.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A03章-热力学第二定律.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A02章 热力学第一定律.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 第四章-多组分系统热力学.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 物理化学绪论.pdf
- 《物理化学》课程教学资源(C)课件 第一章 热力学第一定律.pdf
- 《分析化学》课程教学资源(课件讲稿)第一章 绪论.pdf
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定法.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第七章 电化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第九章 统计热力学.pdf
