《物理化学》课程教学课件(PPT讲稿)第三章 化学势

气体化学势偏摩尔量理想浴液化学势稀溶液第三化学势hyCham非理想溶液浴液化学势依数性习题课
习题课 非理想溶液 依数性 溶液化学势 稀溶液 理想溶液 气体化学势 化学势 偏摩尔量 PhyChemistry

引言$3.01.多组分系统两种或两种以上的物质(或称为组分)所形成的系统称为多组分系统多组分系统可以是均相的,也可以是多相的,(1)混合物(mixture)多组分均匀系统中,各组分均可选用相同的方法处理,有相同的标准态,遵守相同的经验定律,这种系统称为混合物混合物有气态、液态和固态之分
2 § 3.0 引言 1.多组分系统 两种或两种以上的物质(或称为组分)所形成 的系统称为多组分系统。 (1)混合物(mixture) 多组分均匀系统中,各组分均可选用相同的方法 处理,有相同的标准态,遵守相同的经验定律,这 种系统称为混合物。 多组分系统可以是均相的,也可以是多相的。 混合物有气态、液态和固态之分

(2)溶液(Solution)含有一种以上组分的液体相或固体相称之。溶液有液态溶液和固态溶液之分,但没有气态溶液溶剂(solvent)和溶质(solute)如果组成溶液的物质有不同的状态,通常将液态物质称为溶剂气态或固态物质称为溶质如果都具有相同状态,则把含量多的一种称为溶剂,含量少的称为溶质。溶剂和溶质要用不同方法处理,他们的标准态化学势的表示式不同,服从不同的经验定律
3 (2)溶液(Solution) 如果组成溶液的物质有不同的状态,通常将液态 物质称为溶剂,气态或固态物质称为溶质。 如果都具有相同状态,则把含量多的一种称为溶 剂,含量少的称为溶质。 溶剂(solvent)和溶质(solute) 含有一种以上组分的液体相或固体相称之。溶液 有液态溶液和固态溶液之分,但没有气态溶液。 溶剂和溶质要用不同方法处理,他们的标准态、 化学势的表示式不同,服从不同的经验定律

s3.1偏摩尔量PartialmolarquantitiesaGeG,=(on一、定义T,p,nc+B偏摩尔量的物理意义二、三、集合公式G= Gana+ GpnB
11 §3.1 偏摩尔量 Partial molar quantities 一、定义 二、偏摩尔量的物理意义 三、集合公式 , , C B def B B T p n G G n = G = GAnA+ GBnB

为什么要提出偏摩尔量这个概念?对于多组分系统,系统状态不仅仅是两个独立变量(例如温度和压力)的函数如不同浓度的乙醇水溶液V总+nAVmA + ngVm,B浓度V总/cm3Vk/cm3Vz醇/cm310010019244.1%5015019520.8%5015019370.3%对于乙醇水溶液除了指定TP外,还须指定溶液的组成,才能确定系统的状态在组成可变的多组分系统中,1molIB对系统容量性质的贡献可能不同于其在纯态时的摩尔量12
12 为什么要提出偏摩尔量这个概念? 对于多组分系统, 系统状态不仅仅是两个独立变量 (例如温度和压力)的函数 如不同浓度的乙醇水溶液 浓度 V水/cm3 V乙醇/cm3 V总/cm3 44.1% 100 100 192 20.8% 150 50 195 70.3% 50 150 193 对于乙醇水溶液, 除了指定T, p外,还须指定溶液的 组成,才能确定系统的状态。 在组成可变的多组分系统中,1 molB对系统容量性 质X的贡献可能不同于其在纯态时的摩尔量 V总 nAVm,A + nBVm,B

一、定义多组分(k个组分)系统中任一容量性质XX=f(T,p, ni, n2, ng,... nk)axaxax+(x)dT +dx =dn, +dnzapaTanp,nkT,nkT,P,n2,ng...nT,p,ni,ng...nkaxdnk..+Onk/T,p,ni,n3...nk-laxaxax2dT+dp+dnaTBaponBB=1p,nkTnJT,P,nc+Bdefax偏摩尔量XB=onBT,p,nc+B13
13 一、定义 多组分(k个组分)系统中任一容量性质X 2 3 1 3 1 3 1 1 2 , , 1 2 , , , , , , , , , k k k k k p n T n T p n n n T p n n n k k T p n n n X X X X dX dT dp dn dn T p n n X dn n − = + + + + + , , C B def B B T p n X X n = X = f(T, p, n1 , n2 , n3 , nk ) , 1 k , , , k C B k B p n T n B B T p n X X X dT dp dn T p n = = + + -偏摩尔量
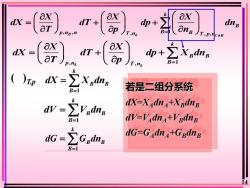
Kaxaxax1dX:dT+dp +dnB一aTOnBapB/T,p,c+BT,nkp,nB,nkaxaxEXednBdxdT +dp +aTopB=1JT,nkp,nkkZXpdnbdX =R若是二组分系统B=1kdX-X.dn+XBdnBdV=ZiVBdngdV-VAdnA+VBdnBB=1kdG-GAdnA+GBdnBEGadndG =B=114
14 , , 1 B , k , , C B k B p n n T n B B T p n X X X dX dT dp dn T p n = = + + 1 k B B B dX X dn = = 1 k B B B dG G dn = = ( )T,p , 1 k , k k B B p n T n B X X dX dT dp X dn T p = = + + 1 k B B B dV V dn = = 若是二组分系统 dX=XAdnA+XBdnB dV=VAdnA+VBdnB dG=GAdnA+GBdnB

二、集合公式一系统:A和B的偏摩尔体积分别为VA,VB 则()T,pdV=V.dna+VBdnB如果由纯物质A(n^),B(nβ)配置该系统:连续加入A和B,并保持系统组成不变,即dna:dnB=na:nB则f"dV = f"^ VAdnA + I"VgdngV= Vana+ VBnB集合公式X= XAnA+XnB16
16 二、集合公式 则 B n A B n A V dV V dn V dn A B = + 0 0 0 一系统:A和B的偏摩尔体积分别为 VA ,VB 则 ( )T,p dV=VAdnA+VBdnB 如果由纯物质A(nA), B(nB)配置该系统: 连续加入A 和B,并保持系统组成不变,即dnA : dnB = nA : nB V = VAnA+ VBnB X = XAnA+ XBnB -集合公式

axtetX,(om)2B)T,p,n注意:1只有容量性质有偏摩尔量;2.偏摩尔量除了与Tp有关外,还与浓度有关3偏摩尔量本身是强度性质;4 . 单组分系统Xβ=Xm(如: VB=Vm,Gβ=Gm)18
18 注意: 1.只有容量性质有偏摩尔量; 2.偏摩尔量除了与T, p有关外,还与浓度有关; 3.偏摩尔量本身是强度性质; 4.单组分系统XB =Xm (如: VB =Vm , GB =Gm ) , , C def B B T p n X X n =

$3.2化学势Chemical PotentialaG一、化学势μB=GBOng )T,p,nc+B二、 化学势的应用19
19 §3.2 化学势 Chemical Potential 一、化学势 二、化学势的应用 , , C B B B B T p n G G n = =
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 山东理工大学:《物理化学》课程考核大纲.pdf
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《分析化学》课程教学资源(课件讲稿)概论 Analytical chemistry.pdf
- 《分析化学》课程课后思考题(含答案)第五章 酸碱滴定.doc
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定.pdf
- 《分析化学》课程教学资源(课件讲稿)第三章 误差与数据分析.pdf
- 《分析化学》课程教学资源(课件讲稿)第一章 绪论.pdf
- 高等教育出版社:《分析化学》课程教材书籍PDF电子版(武汉大学第5版,共十一章).pdf
- 《分析化学》课程教学资源(实验指导)铅、铋含量的测定.doc
- 《分析化学》课程教学资源(实验指导)过氧化氢含量的测定.doc
- 《分析化学》课程教学资源(实验指导)水泥中铁、铝含量的测定.doc
- 《分析化学》课程教学课件(PPT讲稿)绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)第四章 氧化还原滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 重量分析.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 沉淀滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第二章 酸碱滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 络合滴定.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 吸光光度.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡 Chemical Equilibrium.ppt
- 《有机与药物合成化学》课程教学资源(书籍文献)化学ABC.pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)化学ABC之pH和pKa.pdf
- 山东理工大学:《物理化学》课程教学课件(讲稿)第11章 化学动力学基础(一).pdf
- 《物理化学》课程教学课件(PPT讲稿)A11章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)A14章 胶体与大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)A08章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)A09章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)A10章 电解与极化作用.ppt
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A05章 化学平衡.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A06章 相平衡.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A03章-热力学第二定律.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A02章 热力学第一定律.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 第四章-多组分系统热力学.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 物理化学绪论.pdf
- 《物理化学》课程教学资源(C)课件 第一章 热力学第一定律.pdf
- 《分析化学》课程教学资源(课件讲稿)第一章 绪论.pdf
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差与数据处理.pdf
