《分析化学》课程教学资源(课件讲稿)第4章 -第2部分

第4章酸碱滴定法 4.1酸碱平衡的理论基础 4.2酸碱溶液中的分布分数 4.3酸碱溶液pH的计算 4.4酸碱指示剂 4.5酸碱滴定曲线 元酸碱和多元碱的滴定 4.6酸碱滴定应用示例
1 4.1 酸碱平衡的理论基础 4.2 酸碱溶液中的分布分数 4.3 酸碱溶液pH的计算 4.4 酸碱指示剂 4.5 酸碱滴定曲线 一元酸碱和多元碱的滴定 4.6 酸碱滴定应用示例 第4章 酸碱滴定法

43 酸碱溶液DⅡ的计算 ·质子条件式 ·一元(多元)弱酸(碱)溶液pH的计算 ·两性物质溶液pH的计算 ·缓冲溶液pH的计算 山东覆王大军 Analytical Chemistry 2
Analytical Chemistry 2 • 质子条件式 • 一元(多元)弱酸(碱)溶液pH的计算 • 两性物质溶液pH的计算 • 缓冲溶液pH的计算 酸碱溶液pH的计算
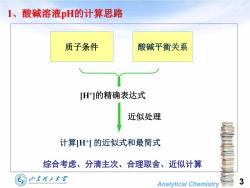
1、酸碱溶液pH的计算思路 质子条件 酸碱平衡关系 [H]的精确表达式 近似处理 计算H1的近似式和最简式 综合考虑、分清主次、合理取舍、近似计算 山东理工大军 HANDONGUNIVERSITYOF TECHNOLOGY Analytical Chemistry 3
Analytical Chemistry 3 1、酸碱溶液pH的计算思路 综合考虑、分清主次、合理取舍、近似计算 质子条件 酸碱平衡关系 [H+ ]的精确表达式 近似处理 计算[H+ ] 的近似式和最简式
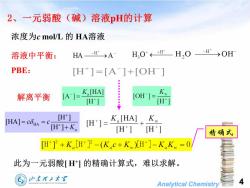
2、一元弱酸(碱)溶液pH的计算 浓度为cmol/L的HA溶液 溶液中平衡: HA-→A H,0*←+H— H,O H→OH PBE: [H]=[A]+[OH] 解离平衡 A= K [HA] [OH]= Kw [H] [H] [HA]=cδHA=C [H] H]= K [HA]Kw H]+K。 [H] [H] 精确式 [H]3+K,[H]-(K,c+K)[H]-KK=O 此为一元弱酸[H1的精确计算式,难以求解。 山东理工大军 Analytical Chemistry
Analytical Chemistry 4 HA [H ] [HA] [H ] a c c K
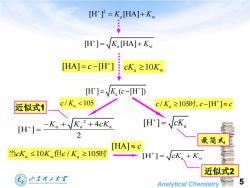
[H子=KHA]+K [H']=VK [HA]+Kw HAIEC I cK≥10Kw [H']=K(c-[H']) 近似式1 c/Ka<105 c/K,≥105时,c-[H]≈c [H]=-K。+VK2+4ck r=风 2 最简式目 当cK,≤10Kv但c/K≥105时 [H']=VcK.+Kw 近似式2 山东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY 5 Analytical Chemistry
Analytical Chemistry 5 a w [H ] [HA] K K a w [HA] [H ] c cK K 10 a [H ] ( [H ]) K c 2 a a a 4 [H ] 2 K K cK a c K c c / 105 [H ] 时, a [H ] cK 最简式 当cK K c K a w a 10 / 105 但 时 a w [H ] cK K a c K/ 105 近似式1 [HA] c 2 a w [H ] [HA] K K 近似式2

一元弱酸水溶液H]计算公式: cKa≥10Kw且c/K≥105H]=VeK cK,≥10K但c/K<105[1=-K+VK,+4cK 2 cKa<10Kw但c/K2≥105[H]=VcKa+Kw 归东翟王大 Analytical Chemistry 6
Analytical Chemistry 6 a w a cK K c K 10 / 105 但 一元弱酸水溶液[H+ ]计算公式: a w a cK K c K 10 / 105 且 a [H ] cK 2 a a a 4 [H ] 2 K K cK cK K c K a w a 10 / 105 但 a w [H ] cK K

例1计算0.10 mol-L-HAc溶液的pH值。 解:已知c=0.10molL,K2=1.8×10-5,cK。>10K 又因为cK>105,故可采用最简式计算。 [H*]=VcK。=V1.8x103x0.10=1.3x10(mol.L) pH=2.87 例2计算0.10moL1一氯乙酸(CH,CIC0OH)溶液的pH值。 解:已知c=0.10 mol-L-,K,=1.4×103,cK。>10K 但c/K,<105,故要采用近似式计算。 [H]=-Kty区2+4K 2 -1.4×10-3+V(1.4×10-3)2+4×1.4×10-3×0.10 =1.1×10-2(mol-L) 2 pH=1.96 归东翟工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 7 例2 计算0.10mol·L-1一氯乙酸(CH2ClCOOH)溶液的pH值。 例1 计算0.10mol·L-1HAc溶液的pH值。 pH=2.87 解:已知c=0.10mol·L-1 ,Ka =1.8×10-5 , 又因为c/Ka>105,故可采用最简式计算。 a Kw cK 10 5 3 1 [ ] 1.8 10 0.10 1.3 10 ( ) H cK mol L a 解:已知c=0.10mol·L-1 ,Ka =1.4×10-3 , 但c/Ka<105,故要采用近似式计算。 a Kw cK 10 2 4 [ ] 2 K K cK a a a H 1.1 10 ( ) 2 1.4 10 (1.4 10 ) 4 1.4 10 0.10 2 1 3 3 2 3 mol L pH=1.96

一元弱碱水溶液[O计算与弱酸类似,只需将 H]→[OH];Ka→Kb 一元弱碱水溶液OⅢ]计算公式: cKb≥10Kw且c/Kb≥105 [OH ]=cK cK,≥10K但c/K。<105[oH]=-K+K。+4cK 2 CK,<l0Kw但c/K,≥105[OH]=VcKb+Kw目 山东覆王大军 Analytical Chemistry 8
Analytical Chemistry 8 b w b cK K c K 10 / 105 但 一元弱碱水溶液[OH- ]计算公式: b w b cK K c K 10 / 105 且 b [ H ] O cK 2 b b b 4 [ H ] 2 K K cK O cK K c K b w b 10 / 105 但 b w [ H ] O cK K 一元弱碱水溶液[OH ]计算与弱酸类似,只需将 [H+ ] [OH ];Ka Kb

3、多元弱酸(碱)溶液pH的计算 多元弱酸分步解离,一般有: K>K>K,.>K 可按一元弱酸处理。 当cKa≥10Kw但c/Ka1≥105 H门=-K+VK2+4ck 2 当cK,≥10Kw且c/K,≥105 [H]=√cK 中东翟王大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 9
Analytical Chemistry 3、多元弱酸(碱)溶液pH的计算 多元弱酸分步解离,一般有: 1 2 3 a a a an K K K K 2 a1 a1 a1 4 [H ] 2 K K cK a1 [H ] cK 可按一元弱酸处理。 a1 w a1 当 cK K c K 10 / 105 但 a1 w a1 当 cK K c K 10 / 105 且 9

多元弱碱溶液 K>K2>K3.>Km 当cKb≥10Kw但c/Kb1<105时 [OH ]=-K+K2+4cKpl 2 当cKb1≥10K且c/Kb1≥105时 [OH ]=VcKpI 归东翟王大 Analytical Chemistry 10
Analytical Chemistry K K K K b1 b2 b3 bn 多元弱碱溶液 b1 w b1 当cK K c K 10 / 105 但 时 2 b1 b1 b1 4 [OH ] 2 K K cK b1 w b1 当cK K c K 10 / 105 且 时 b1 [OH ] cK 10
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(课件讲稿)第4章 -第1部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第2章 误差及分析数据的统计处理.pdf
- 《分析化学》课程教学资源(课件讲稿)第1章 绪论、第3章 滴定分析.pdf
- 山东理工大学:《物理化学》课程授课计划(A)Ⅱ.doc
- 《物理化学》课程教学资源(D)物理化学(D)第九章 第九章 化学动力学基本原理.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第十章 界面现象.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第十二章 胶体化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第十一章 化学动力学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第八章 量子力学基础.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第九章 统计热力学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第七章 电化学.pdf
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)第一章 绪论.pdf
- 《物理化学》课程教学资源(C)课件 第一章 热力学第一定律.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 物理化学绪论.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 第四章-多组分系统热力学.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A02章 热力学第一定律.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A03章-热力学第二定律.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 A06章 相平衡.pdf
- 《分析化学》课程教学资源(课件讲稿)第4章 -第3部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第5章 -第1部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第5章 -第2部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第5章 -第3部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第6章 氧化还原滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)第7章 重量分析法和沉淀滴定法.pdf
- 《分析化学》课程课堂练习(含答案)第2章 课堂练习答案.doc
- 《分析化学》课程课堂练习(含答案)第4章 课堂练习答案.doc
- 《分析化学》课程课堂练习(含答案)第6章 课堂练习答案.doc
- 《分析化学》课程课堂练习(含答案)第7章 课堂练习答案.doc
- 《分析化学》课程教学资源(课件讲稿)分光光度法.pdf
- 《分析化学》课程教学资源(课件讲稿)氧化还原滴定法.pdf
- 《分析化学》课程教学课件(PPT讲稿)吸光光度法法(Absorptiometry).ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法(Oxidation-Reduction Titration).ppt
- 《分析化学》课程教学资源(课件讲稿)沉淀滴定.pdf
- 《分析化学》课程教学课件(PPT讲稿)络合滴定法(Complexmetric Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)误差及数据处理.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱平衡与酸碱滴定法(acid-base equilibrium and titration).ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析法(Gravimetry).ppt
