《分析化学》课程教学资源(课件讲稿)第7章 重量分析法和沉淀滴定法

第7章重量分析法和沉淀滴定法 7.1重量分析概述 7.2重量分析对沉淀的要求 7.3沉淀完全的程度与影响沉淀溶解度的因素★ 7.5沉淀的形成与沉淀的条件 7.6重量分析结果的计算 7.7沉淀滴定法概述 7.8银量法滴定终点的确定
1 第7章 重量分析法和沉淀滴定法 7.1 重量分析概述 7.2 重量分析对沉淀的要求 7.3 沉淀完全的程度与影响沉淀溶解度的因素 7.5 沉淀的形成与沉淀的条件 7.6 重量分析结果的计算 7.7 沉淀滴定法概述 7.8 银量法滴定终点的确定

7.1 重量分析概述 1、重量法的分类 分类 分离 称重 气化法 待测组分挥发逸出,根据试样量的减少 计算该组分的含量。如结晶水的测定。 电解法 以测量沉积于电极表面的沉积物的重量为 基础的定量分析方法。 沉淀剂,R 沉淀型,P1 沉淀法 待测物质,X =P2 P1 称量型, 归东罪王大军 #P2 Analytical Chemistry 2
Analytical Chemistry 2 重量分析概述 1、重量法的分类 分类 以测量沉积于电极表面的沉积物的重量为 基础 的定量分析方法。 待测物质,X 沉淀剂,R 沉淀型,P1 称量型,P2 P1 = P2 ≠P2 沉淀法 气化法 待测组分挥发逸出,根据试样量的减少 计算该组分的含量。如结晶水的测定。 电解法 分 离 称 重

2、重量法的特点 特点 不需用基准物质 准确度高 不适用于微量分析 程序长、费时 3、应用 主要应用于含量不太低的Si,S,Ni等元素的精确分析 山东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 3
Analytical Chemistry 3 特点 不需用基准物质 准确度高 不适用于微量分析 程序长、费时 3、应用 主要应用于含量不太低的Si, S, Ni 等元素的精确分析 2、重量法的特点
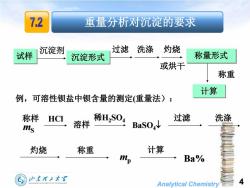
7.2 重量分析对沉淀的要求 过滤洗涤 灼烧 试样 沉淀剂 沉淀形式 称量形式 或烘干 称重 计算 例,可溶性钡盐中钡含量的测定(重量法): 称样 HCI 过滤 洗涤 ms 溶样 稀H2S04 BaSO4↓ 灼烧 称重 计算 p Ba% 山东理王大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 4 溶样 HCl 稀H2SO4 BaSO4 过滤 洗涤 灼烧 称重 计算 Ba% 称样 mS mp 例,可溶性钡盐中钡含量的测定(重量法): 试样 过滤 洗涤 灼烧 或烘干 称量形式 称重 计算 沉淀形式 沉淀剂 重量分析对沉淀的要求

对沉淀形式的要求 溶解度小 易过滤、洗涤 纯度高 易于转化 对称量形式的 要求 有确定的化学组成 稳定,不易与02,H,0,C02反应 摩尔质量足够大 例:测AI NH3 灼烧 AI Al(OH)34 Al203 称量误差 0.1000g 0.1888g 0.0002 ×100%=016% 0.1888 8羟基喹啉 烘干 AI AI(CH NO)34 → AI(CgH6NO)3↓ 0.1000g 0.0002 ×100%=0.012% 1.704g 1.704 山东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 5
Analytical Chemistry 5 对 沉淀形式 的要求 溶解度小 易过滤、洗涤 纯度高 易于转化 对 称量形式 的 要求 有确定的化学组成 稳定,不易与O2 , H2O, CO2 反应 摩尔质量足够大 例:测Al Al NH3 Al(OH)3↓ 0.1000g 0.1888g 灼烧 Al2O3 Al 8-羟基喹啉 Al(C9H6NO)3↓ 烘干 Al(C9H6NO)3↓ 0.1000g 1.704g 称量误差 0.0002 100% 0.16% 0.1888 0.0002 100% 0.012% 1.704
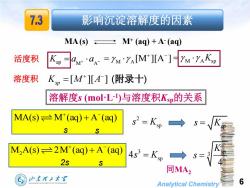
7.3 影响沉淀溶解度的因素 MA(s)M+(ag)+A-(ag) 活度积 Ma-=YM'YA[M']LA ]-YM'YAKSP 溶度积 K,=[M][A](附录十) 溶解度s(moLl)与溶度积Ksp的关系 MA(s)≥M(aq)+A(aq) →S= S s MA(s)≥2M(aq)+A(aq) S= 2s 同MA2 归东理子大军 Analytical Chemistry 6
Analytical Chemistry [ ][ ] K M A sp 影响沉淀溶解度的因素 溶度积 ap M A 活度积 K a a M A [M ][A ] M A Ksp (附录十) 6 MA(s) M+ (aq) + A- (aq) 溶解度s (mol·L-1 )与溶度积Ksp的关系 MA(s) M (aq) A (aq) 2 sp s K s s sp s K M A(s) 2M (aq) A (aq) 2 3 sp 4s K 2s s sp 3 4 K s 同MA2
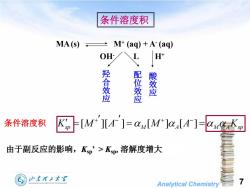
条件溶度积 MA(s) M+(aq)+A-(aq) OH L H 羟合效应 签 酸效应 条件溶度积 K[M][4]=a[M]L4]-=uK2 由于副反应的影响,Kp'>Kp,溶解度增大 少东翟王大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 7 OH- L H+ MA(s) M+ (aq) + A- (aq) [ ][ ] [ ] [ ] K M A M A K sp M A M A sp 由于副反应的影响,Ksp’ > Ksp,溶解度增大 条件溶度积 羟 合 效 应 配 位 效 应 酸 效 应 条件溶度积

影响沉淀溶解度的因素 1、同离子效应 因加入含有相同离子的易溶强电解质,而使难溶电 解质溶解度降低的效应称之为同离子效应。 例求BaSO,在纯水中的溶解度和在0.10 molL- Na2SO,溶液中的溶解度。己知Km(BaSO4)=1.1×10-1o (1)BaS0,在水中溶解度s=√K,=1.0×105mol.L (2)在Na2S04溶液中溶解度 s(0.10+S)=Kps≈ K2=1.1×10mol- 0.10 归东理工大军 Analytical Chemistry 8
Analytical Chemistry 8 影响沉淀溶解度的因素 1、同离子效应 因加入含有相同离子的易溶强电解质,而使难溶电 解质溶解度降低的效应称之为同离子效应。 例 求 BaSO4 在 纯 水 中 的 溶 解 度 和 在 0.10 mol·L-1 Na2 SO4溶液中的溶解度。已知Ksp(BaSO4 )=1.1×10-10 (1)BaSO4在水中溶解度 5 1 sp s K 1.0 10 mol L sp 9 1 sp (0.10 s) , 1.1 10 mol L 0.10 K s K s (2)在Na2SO4溶液中溶解度

2、盐效应 在难溶电解质饱和溶液中,加入不含有相同离 子的易溶强电解质而使难溶电解质的溶解度增大 的作用称为盐效应。 AgC1在KNO3溶液中的溶解度(25℃) c(KNO3 )/(mol.L-) 0.00 0.0010 0.00500 0.0100 s(AgCl))/(mol.L-1) 1.278 1.325 1.385 1.427 中东翟王大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 9 2、盐效应 在难溶电解质饱和溶液中,加入不含有相同离 子的 易溶强电解质而使难溶电解质的溶解度增大 的作用称为盐效应。 AgCl在KNO3溶液中的溶解度 (25℃ ) s(AgCl) )/(mol.L 1.278 1.325 1.385 1.427 -1 ) c(KNO3 )/(mol.L 0.00 0.0010 0.00500 0.0100 -1 )

3、酸效应 溶液酸度对弱酸盐沉淀溶解度的影响 例:在含有固体CaCO,的饱和溶液中加入盐酸,系 统存在下列平衡的移动。 CaCO (s)Ca2++CO HCI→CI+H ① HC0?+H台H,C03→H20+C02个 山东覆王大军 Analytical Chemistry 10
Analytical Chemistry 10 例:在含有固体CaCO3的饱和溶液中加入盐酸,系 统存在下列平衡的移动。 3 2 3 2 2 2 3 2 3 HCO H H CO H O CO HCl Cl H CaCO (s) Ca CO 3、酸效应 溶液酸度对弱酸盐沉淀溶解度的影响
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(课件讲稿)第6章 氧化还原滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)第5章 -第3部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第5章 -第2部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第5章 -第1部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第4章 -第3部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第4章 -第2部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第4章 -第1部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第2章 误差及分析数据的统计处理.pdf
- 《分析化学》课程教学资源(课件讲稿)第1章 绪论、第3章 滴定分析.pdf
- 山东理工大学:《物理化学》课程授课计划(A)Ⅱ.doc
- 《物理化学》课程教学资源(D)物理化学(D)第九章 第九章 化学动力学基本原理.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第十章 界面现象.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第十二章 胶体化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第十一章 化学动力学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第八章 量子力学基础.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第九章 统计热力学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第七章 电化学.pdf
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)第一章 绪论.pdf
- 《分析化学》课程课堂练习(含答案)第2章 课堂练习答案.doc
- 《分析化学》课程课堂练习(含答案)第4章 课堂练习答案.doc
- 《分析化学》课程课堂练习(含答案)第6章 课堂练习答案.doc
- 《分析化学》课程课堂练习(含答案)第7章 课堂练习答案.doc
- 《分析化学》课程教学资源(课件讲稿)分光光度法.pdf
- 《分析化学》课程教学资源(课件讲稿)氧化还原滴定法.pdf
- 《分析化学》课程教学课件(PPT讲稿)吸光光度法法(Absorptiometry).ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法(Oxidation-Reduction Titration).ppt
- 《分析化学》课程教学资源(课件讲稿)沉淀滴定.pdf
- 《分析化学》课程教学课件(PPT讲稿)络合滴定法(Complexmetric Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)误差及数据处理.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱平衡与酸碱滴定法(acid-base equilibrium and titration).ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析法(Gravimetry).ppt
- 《物理化学》课程教学课件(PPT讲稿)02章 热力学第一定律1/2.ppt
- 《物理化学》课程教学课件(PPT讲稿)02章 热力学第一定律2/2.ppt
- 《物理化学》课程教学课件(PPT讲稿)03章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)04章 多组分系统热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)05章 相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)06章 化学平衡.ppt
