《分析化学》课程教学资源(课件讲稿)第5章 -第2部分

第5章配位滴定法 5.1概述 5.2 EDTA与金属离子的配合物及其稳定性 5.3外界条件对EDTA与金属离子配合物稳定性的影响 5.4配位滴定曲线 5.5金属指示剂确定滴定终点的方法 5.7配位滴定的方式和应用
1 5.1 概述 5.2 EDTA与金属离子的配合物及其稳定性 5.3 外界条件对EDTA与金属离子配合物稳定性的影响 5.4 配位滴定曲线 5.5 金属指示剂确定滴定终点的方法 5.7 配位滴定的方式和应用 第5章 配位滴定法
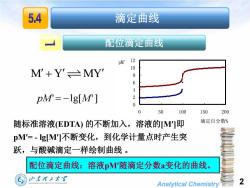
5.4 滴定曲线 配位滴定曲线 pM12 M+Y'≌MY' 10 8 6 4 pM=-1g[M'] 0 0 50 100 150 200 随标准溶液(EDTA)的不断加入,溶液的M'I即 滴定百分数% pM'=-gMI不断变化,到化学计量点时产生突 跃,与酸碱滴定一样绘制曲线。 配位滴定曲线:溶液p'随滴定分数a变化的曲线。 山东理工大军 HANDONGUNIVERSITYOF TECHNOLOGY Analytical Chemistry 2
Analytical Chemistry 2 pM' lg[M'] M Y MY 滴定曲线 配位滴定曲线 配位滴定曲线:溶液pM随滴定分数a变化的曲线。 0 2 4 6 8 10 12 0 50 100 150 200 滴定百分数% pM' 随标准溶液(EDTA) 的不断加入,溶液的[M]即 pM= - lg[M]不断变化,到化学计量点时产生突 跃,与酸碱滴定一样绘制曲线

I例]pH=9.0,0.01000mol/L的EDTA滴定20.00mL, 0.01000mol/L的Zn2+(IgKzny-16.5,pH=9.0,lgy0m=1.28, Igazn(OH)-0.2) [解] IgK'zny =1g KznY-Igazn-lgay =15.02 1、滴定前 pZn'=-1g[Zn']=-1gCzn =2.00 2、sp前Zl=a-=0.1%c8 p Zn 7n Vzn +Vy 加入19.98 ml EDTA pZn'=5.30 上本理工大客 Analytical Chemistry 3
Analytical Chemistry 3 [例] pH=9.0,0.01000mol/L的EDTA滴定20.00mL, 0.01000mol/L的Zn2+( lgKZnY=16.5, pH=9.0, lgαY(H)=1.28, lgαZn(OH)=0.2 ) [解] lgK' ZnY lgKZnY lgZn lgY 15.02 1、滴定前 pZn' lg[Zn'] lgCZn 2.00 2、sp前 Zn Zn Y sp Zn Zn Y ( ) [Zn'] 0.1% c V V c V V 加入19.98ml EDTA pZn =5.30 sp Zn Zn 2 c c

3、sp时 KZnY ZnY1sp-=10l5.02 [Zn'Isp[Y Isp [ZnY"lp≈c [Zn']sp =[Y']sp 注: 2= 2 c叨 [Zn'Isp=1K'ZnY pZn'-(8Kzay +po)6.40 4、Sp后 小 [ZnY'] [ZnY]≈c y=-)=0,1%c Vin +Vy 加入20.02 ml EDTA pZn'=12.02 山东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 4 3、sp时 15.02 sp sp ' sp ZnY 10 [Zn'] [Y' ] [ZnY' ] K (lg ' p ) 6.40 2 1 pZn ' sp sp ZnY Zn K c sp sp Zn [ZnY'] c sp sp [Zn'] [Y'] ZnY sp sp ' [Zn'] Zn K c 注: 4、sp后 ' [Y' ] [ZnY' ] [Zn'] K ZnY 加入20.02ml EDTA sp Zn [ZnY'] c pZn =12. 02 Zn Y Zn sp Zn Zn Y ( ) [Y'] 0.1% c V V c V V sp Zn Zn 2 c c

一、 化学计量点时p'和pM的计算 [M'lsp= M K'MY pM('+pe 注:M,=M PMp=PMp+Ig&M 山东覆王大军 Analytical Chemistry 5
Analytical Chemistry 5 一、化学计量点时pM 和pM的计算 (lg ' p ) 2 1 p M ' sp sp MY M K c MY sp sp ' [M '] M K c 注: M sp sp [M '] [M ] p Msp p Msp 'lg M

例:pH=10的氨性缓冲溶液中,NH3=0.2mol/L,用0.02mol/L EDTA滴定0.02 mol/LCu2+,计算sp时pC'(已知pH=10时, Cu(OH=101.7,lg4y卿=-0.45)。 sp时,c"=0.01mol/L,NH,]=0.1mol/L cuH,)=1+BNH,]+B,NH,]+.+B,NH]4=10936 eMcD =101 O.。=%.om+acn-1=l0w pH=10.0,lg¥m=0.45 Ig K'cuy =Ig Kcuy -1gacu-1g aY( =18.80-9.36-0.45=8.99 p0u=2(pCup+lgK.m)-=)2.00+8.9)=550 少东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 6
Analytical Chemistry 6 例:pH =10 的氨性缓冲溶液中,[NH3 ]= 0.2 mol/L, 用0.02mol/L EDTA滴定0.02mol/L Cu2+ ,计算 sp 时pCu(已知pH=10时, αCu(OH) =101.7 ,lgαY(H) =0.45 )。 sp 0.01mol/L, [NH3 ] 0.1mol/L s p 时,c C u 3 2 4 9.36 Cu NH ) 1 3 2 3 4 3 1 [NH ] [NH ] . [NH ] 10 ( 1.7 Cu(OH) 10 9.3 6 Cu Cu(OH) Cu(NH3) 1 10 p H 10.0, lg Y(H) 0.45 CuY CuY Cu Y(H) lg ' lg lg lg 18.80 9.36 0.45 8.99 K K (2.00 8.99) 5.50 2 1 (pCu lg ' ) 2 1 pCu' s p K CuY
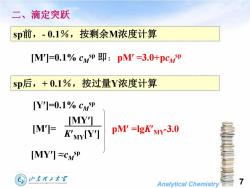
二、滴定突跃 sp前,-0.1%,按剩余M浓度计算 [M']=0.1%cMp即:pM'=3.0+pcMP Sp后,+0.1%,按过量Y浓度计算 [Y']=0.1%cwP [MY] [M']= KyylY] pM'=IgK'My-3.0 [MY'"I≈CwP 山东覆王大军 Analytical Chemistry
Analytical Chemistry 7 sp前,- 0.1%,按剩余M浓度计算 sp后,+ 0.1%,按过量Y浓度计算 [M]=0.1% cM sp 即:pM =3.0+pcM sp [Y]=0.1% cM sp [M]= [MY] K MY[Y] [MY] ≈cM sp pM =lgK MY-3.0 二、滴定突跃

影响滴定突跃的因素(3.0+pcMP~lgK3.0) 1、y对pM'突跃大小的影响: >K:增大10倍,突跃增加1个pM单位(上限) (I)Ky增大,相应增大,突跃变大 (2)a越大,K越小,突跃变小 aYH]↑,aY↑,KY↓,突跃变小 a:变大后,突跃变小 3)a越大,K越小,突跃变小 aM 广ZMO):[OH个,O,KY,突跃变小 a缓冲溶液及其他辅助络配体浓度↑,a↑, Yl,突跃变小 山东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 8
Analytical Chemistry 8 K MY: 增大10倍,突跃增加1个pM单位(上限) (1) KMY增大,K MY相应增大,突跃变大 (2) Y越大, K MY越小,突跃变小 影响滴定突跃的因素( 3.0+pcM sp ~ lgK MY-3.0 ) 1、 K' MY对pM'突跃大小的影响: (3) M越大, K MY越小,突跃变小 αY αY(H): [H+ ]↑, αY(H)↑, K MY↓, 突跃变小 αY(N): 变大后,突跃变小 αM αM(OH): [OH- ]↑, αM(OH) ↑, K MY↓, 突跃变小 αM(L) :缓冲溶液及其他辅助络配体浓度↑, αM(L) ↑, K MY↓, 突跃变小

2、c对突跃的影响: >c增大10倍,突跃增加1个pM单位(下限) 14 Ig K'My=14 13 10 Ig K'My=10 12 10 10 以 8 6人 10'mol.L 10'mol-L 0.01 mol.L 10mol-L 10'mol-L 1.00 1.00 2.00 滴定分数 滴定分数 不同gKMx时的滴定曲线 不同浓度EDTA与M的滴定曲线 归东翟王大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 9
Analytical Chemistry 9 2、cM对突跃的影响: cM增大10倍,突跃增加1个pM单位(下限)

准确滴定判别式 用配位滴定法测定时所需的条件,取决于允许的误差(E) 和目测终点的不确定度(△pM')。 目测确定终点:△pM'=±0.2~士0.5, 前提条件:E4≤士0.1%,△pM=±0.2 准确滴定的判别式: lg(cKY)≥6 少东翟王大军 HANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 10
Analytical Chemistry 10 准确滴定的判别式: sp M MY lg( ' ) 6 c K 准确滴定判别式 用配位滴定法测定时所需的条件,取决于允许的误差(Et) 和目测终点的不确定度(pM')。 目测确定终点: pM '= ±0.2 ~± 0.5, 前提条件: Et ± 0.1%, pM' = ±0.2
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(课件讲稿)第5章 -第1部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第4章 -第3部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第4章 -第2部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第4章 -第1部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第2章 误差及分析数据的统计处理.pdf
- 《分析化学》课程教学资源(课件讲稿)第1章 绪论、第3章 滴定分析.pdf
- 山东理工大学:《物理化学》课程授课计划(A)Ⅱ.doc
- 《物理化学》课程教学资源(D)物理化学(D)第九章 第九章 化学动力学基本原理.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第十章 界面现象.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第十二章 胶体化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第十一章 化学动力学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第八章 量子力学基础.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第九章 统计热力学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 物理化学(A)Ⅱ 课件 第七章 电化学.pdf
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差与数据处理.pdf
- 《分析化学》课程教学资源(课件讲稿)第一章 绪论.pdf
- 《物理化学》课程教学资源(C)课件 第一章 热力学第一定律.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 物理化学绪论.pdf
- 《物理化学》课程教学资源(B)Ⅰ 物理化学(A)Ⅰ 天大第六版 第四章-多组分系统热力学.pdf
- 《分析化学》课程教学资源(课件讲稿)第5章 -第3部分.pdf
- 《分析化学》课程教学资源(课件讲稿)第6章 氧化还原滴定法.pdf
- 《分析化学》课程教学资源(课件讲稿)第7章 重量分析法和沉淀滴定法.pdf
- 《分析化学》课程课堂练习(含答案)第2章 课堂练习答案.doc
- 《分析化学》课程课堂练习(含答案)第4章 课堂练习答案.doc
- 《分析化学》课程课堂练习(含答案)第6章 课堂练习答案.doc
- 《分析化学》课程课堂练习(含答案)第7章 课堂练习答案.doc
- 《分析化学》课程教学资源(课件讲稿)分光光度法.pdf
- 《分析化学》课程教学资源(课件讲稿)氧化还原滴定法.pdf
- 《分析化学》课程教学课件(PPT讲稿)吸光光度法法(Absorptiometry).ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法(Oxidation-Reduction Titration).ppt
- 《分析化学》课程教学资源(课件讲稿)沉淀滴定.pdf
- 《分析化学》课程教学课件(PPT讲稿)络合滴定法(Complexmetric Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)误差及数据处理.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱平衡与酸碱滴定法(acid-base equilibrium and titration).ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析法(Gravimetry).ppt
- 《物理化学》课程教学课件(PPT讲稿)02章 热力学第一定律1/2.ppt
- 《物理化学》课程教学课件(PPT讲稿)02章 热力学第一定律2/2.ppt
- 《物理化学》课程教学课件(PPT讲稿)03章 热力学第二定律.ppt
