内蒙古科技大学:《普通化学》课程授课教案(讲义)第七章 高分子化合物与材料

第七章高分子化合物与材料 7.1、 非金属单质和化合物的物理性质 7.1.1、 熔点、沸点、硬度和晶体结构 如5.4节所述,晶体微粒间作用力的性质和大小,对晶体的熔点、沸点、硬度等性质 有重大影响。而晶体在工程材料中占有十分重要的地位,若能事先根据单质或化合物的组 成与结构,以及组成元素在周期表中的位置,区分晶体所属类型并判别微粒间作用力的大 小,就可大致了解品体所具有的一般性质,这对选择和使用工程材料无疑是十分有益的。 面联系非金属单质及其重要化合物所属品体类别来讨论性质, 1.非金属单质 目前已知的22种非金属元素大都集中在周期表右上方,除氢①外,都在p区。非金属 元素单质的品体结构见表7.1及图7.1。除稀有气体以单原子分子存在外,所有其他非金 属单质都至少由两个原子通过共价键结合在 合而成的双原 属分子晶体 周期表中部的金刚石 硅 由很 含而成的 子品体(其4 每个原子均以4个sp杂化轨道参 与成键),硼也近于原子晶体:处于区非金 属与金属边界的磷、砷、硒、碲,甚至碳(石墨)②等出现了层状、链状等过渡型结构的多 种同素异性体。 非金属单质的熔点、沸点、硬度,按周期表呈现明显的规律:两边(左边的H,右边的 稀有气体、卤素等)的较低,中间(C、S1等原子晶体)的较高。有关数据已列在图6.1一图 这完全 他们的品体结构相适应 。例如,非 ,出 每个原子以sp杂化轨道 形成具有金刚石型结构[见图7.1()]的原子晶体,整个晶品体由共价键联系着,晶格较牢固 熔点、沸点高,硬度大。但随后的元素由于未配对电子数逐渐减少,不再以s即杂化轨道形 成原子晶体。常见的单质磷为黄磷(又称为白磷)和红磷。黄磷品体是由单个的P分子通过 分子间力结合形成的分子晶体。红磷的品体结构还没有十分肯定,有人认为它是链状结构 晶体。在一定条件下黄磷也可转变成一种黑色的同素异性体,叫做黑磷。 黑磷具有石思状 的层状结构,并有导电性。常见的单质硫(正交硫、单斜硫)晶体是由单个S分子[见图7.1)]
第七章 高分子化合物与材料 7.1、 非金属单质和化合物的物理性质 7.1.1、 熔点、沸点、硬度和晶体结构 如 5.4 节所述,晶体微粒间作用力的性质和大小,对晶体的熔点、沸点、硬度等性质 有重大影响。而晶体在工程材料中占有十分重要的地位,若能事先根据单质或化合物的组 成与结构,以及组成元素在周期表中的位置,区分晶体所属类型并判别微粒间作用力的大 小,就可大致了解晶体所具有的一般性质,这对选择和使用工程材料无疑是十分有益的。 下面联系非金属单质及其重要化合物所属晶体类别来讨论性质。 1.非金属单质 目前已知的 22 种非金属元素大都集中在周期表右上方,除氢①外,都在 p 区。非金属 元素单质的晶体结构见表 7.1 及图 7.1。除稀有气体以单原子分子存在外,所有其他非金 属单质都至少由两个原子通过共价键结合在一起。例如,H2、卤素、O2、N2都是由共价键结 合而成的双原子分子,属分子晶体;周期表中部的金刚石、硅是由很多原子结合而成的原 子晶体(其中每个原子均以 4 个 sp 3杂化轨道参与成键),硼也近于原子晶体;处于 p 区非金 属与金属边界的磷、砷、硒、碲,甚至碳(石墨)②等出现了层状、链状等过渡型结构的多 种同素异性体。 非金属单质的熔点、沸点、硬度,按周期表呈现明显的规律:两边(左边的 H2,右边的 稀有气体、卤素等)的较低,中间(C、Si 等原子晶体)的较高。有关数据已列在图 6.1~图 6.3 中。这完全与他们的晶体结构相适应。例如,非金属硅,由于每个原子以 sp 3杂化轨道 形成具有金刚石型结构[见图 7.1(d)]的原子晶体,整个晶体由共价键联系着,晶格较牢固, 熔点、沸点高,硬度大。但随后的元素由于未配对电子数逐渐减少,不再以 sp 3杂化轨道形 成原子晶体。常见的单质磷为黄磷(又称为白磷)和红磷。黄磷晶体是由单个的 P 4分子通过 分子间力结合形成的分子晶体。红磷的晶体结构还没有十分肯定,有人认为它是链状结构 晶体。在一定条件下黄磷也可转变成一种黑色的同素异性体,叫做黑磷。黑磷具有石墨状 的层状结构,并有导电性。常见的单质硫(正交硫、单斜硫)晶体是由单个S 8分子[见图 7.1(b)] 通
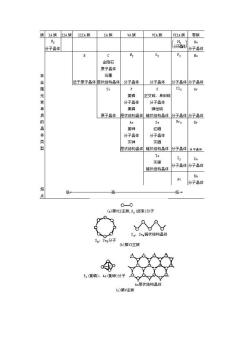
IIA族 IA族 V族 IA黄 VIA族零族 He 分子品体 份子品体 B 2 0 金石 原子晶体 石墨 金属元 近于原子品体层状结构品体 分子品体 分子品体 分子品体分子品体 Si c12 A 黄磷 正交硫、单料斜好 分子品体 分子品体 果磷 弹性硫 质的晶 原子晶 状结构晶体链状结构品体分子晶体分子品体 As 董种 红硒 分子易体 分子品体 灰砷 灰西 层状结构品体链状结构品修 分子品体外 Te 灰蹄 分子晶体份子品体 链状结构晶体 分子品体 家 低+ (a)第I主族,x,卤索)分子 SxS,链状结构品体 S、 S分子 b)第主族 P黄磷)、A黄砷)分子

()第I主族C(金图石)、S原子品体 图7】一些丰金属单质的分子或品体结构示意图 过分子间力结合而成的分子晶体。将约250℃的液态硫迅速倾入冷水,硫就凝结成可 以拉伸的弹性物质,叫做弹性硫(S)。弹性硫具有链状结构。自硅至磷(以及其后的硫、氯 氩),由于单质的晶体结构从原子晶体突然变到分子晶体,晶体中晶格微粒间的作用力骤然 变小(由原子晶体中的强大共价键变为分子晶体中的弱小分子间力),单质的熔点、沸点急 剧降低。另一条规律是,稀有气体、卤素(氧族和氮族也基本如此)的熔点、沸点从上到下 逐渐升高,这与同族元素单质从上到下分子体积增大(从而色散力增大)的方向相一致。所 以稀有气体的熔点、沸点是同周期单质中最低的,氢的熔点、沸点又是所有物质中最低的。 、Ar、He等常用作低温介质和保护气氛(见7.3.2) 2.卤化物 卤化物是指卤素与电负性比卤素小的元素所组成的二元化合物。卤化物中着重讨论氯 化物。 表7.2和表7.3中分别列出了一些氯化物的熔点和沸点。从表中可以看出,大致分成 三种情况:活泼金屈的氯化物如NaC1、KC1、BaC1,等的熔点、沸点较高: 非金属的氯化物 如PCl、Cl,、SiC,等的熔点、沸点都很低:而位于周期表中部的金属元素的氯化物如A1C1、 FeC1、CrCl、ZnC1,等的熔点、沸点介于两者之间,大多偏低。 离子型卤化物中NaC1、KCl、BaCl熔点、沸点较高,稳定性好,受热不易分解,这类 氯化物的熔融态可用作高温时的加热介质,叫做盐溶剂。CaF2、NaC1、KBr晶体可用作红 外光谱仪棱镜。位于周期表中部元素的卤化物中过渡型的A1C1、CC1及分子型的SiC1 易挥发,通常稳定性较好,但在高温时能在钢铁工件表面分解出具有活性的铝或铬、硅原 子,渗入工件表层,因而可用于渗铝、渗铬、渗硅工艺中(见6.4节);易气化的SC1、 SiHC1,(三氯硅甲烷)可被还原为硅而用于半导体硅的制取。利用共价型WIp(二碘化钨)易挥 发,且稳定性差,高温能分解为单质的性质,可在灯管中加入少量碘制得碘钨灯。当灯管 中钨丝受热升华到灯管壁(温度维持在250~650℃)时,可以与碘化合成WI2。WI:蒸气又扩 散到整个灯管,碰到高温的钨丝便重新分解,并又把钨沉积在灯丝上。这样循环不息,可 以大大提高灯的发光效率和寿命】 物质的熔点、沸点主要决定于物质的晶体结构。氯是活泼非金属,它与很活泼金属N K、B等化合形成离子型氯化物,晶态时是离子品体,晶格点上的正、负离子间作用着较 强的离子键,品格能大,因而熔点、沸点较高:氯与非金属化合形成共价型氯化物,固态 时是分子晶体,因而熔点、沸点较低。但氯与一 表7.2氯化物的熔点(℃)
过分子间力结合而成的分子晶体。将约 250℃的液态硫迅速倾入冷水,硫就凝结成可 以拉伸的弹性物质,叫做弹性硫(Sx)。弹性硫具有链状结构。自硅至磷(以及其后的硫、氯、 氩),由于单质的晶体结构从原子晶体突然变到分子晶体,晶体中晶格微粒间的作用力骤然 变小(由原子晶体中的强大共价键变为分子晶体中的弱小分子间力),单质的熔点、沸点急 剧降低。另一条规律是,稀有气体、卤素(氧族和氮族也基本如此)的熔点、沸点从上到下 逐渐升高,这与同族元素单质从上到下分子体积增大(从而色散力增大)的方向相一致。所 以稀有气体的熔点、沸点是同周期单质中最低的,氦的熔点、沸点又是所有物质中最低的。 N2、Ar、He 等常用作低温介质和保护气氛(见 7.3.2)。 2.卤化物 卤化物是指卤素与电负性比卤素小的元素所组成的二元化合物。卤化物中着重讨论氯 化物。 表 7.2 和表 7.3 中分别列出了一些氯化物的熔点和沸点。从表中可以看出,大致分成 三种情况:活泼金属的氯化物如 NaCl、KCl、BaCl2等的熔点、沸点较高;非金属的氯化物 如 PCl3、CCl4、SiCl4等的熔点、沸点都很低;而位于周期表中部的金属元素的氯化物如 AlCl3、 FeCl3、CrCl3、ZnCl2等的熔点、沸点介于两者之间,大多偏低。 离子型卤化物中 NaCl、KCl、BaCl2熔点、沸点较高,稳定性好,受热不易分解,这类 氯化物的熔融态可用作高温时的加热介质,叫做盐溶剂。CaF2、NaCl、KBr 晶体可用作红 外光谱仪棱镜。位于周期表中部元素的卤化物中过渡型的 AlCl3、CrCl2及分子型的 SiCl4 易挥发,通常稳定性较好,但在高温时能在钢铁工件表面分解出具有活性的铝或铬、硅原 子,渗入工件表层,因而可用于渗铝、渗铬、渗硅工艺中(见 6.4 节);易气化的 SiCl4、 SiHCl3(三氯硅甲烷)可被还原为硅而用于半导体硅的制取。利用共价型 WI2(二碘化钨)易挥 发,且稳定性差,高温能分解为单质的性质,可在灯管中加入少量碘制得碘钨灯。当灯管 中钨丝受热升华到灯管壁(温度维持在 250~650℃)时,可以与碘化合成 WI2。WI2蒸气又扩 散到整个灯管,碰到高温的钨丝便重新分解,并又把钨沉积在灯丝上。这样循环不息,可 以大大提高灯的发光效率和寿命。 物质的熔点、沸点主要决定于物质的晶体结构。氯是活泼非金属,它与很活泼金属 Na、 K、Ba 等化合形成离子型氯化物,晶态时是离子晶体,晶格点上的正、负离子间作用着较 强的离子键,晶格能大,因而熔点、沸点较高;氯与非金属化合形成共价型氯化物,固态 时是分子晶体,因而熔点、沸点较低。但氯与一 表 7.2 氯化物的熔点(℃)
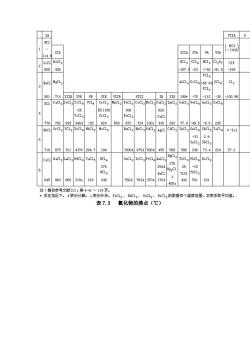
IA VIA w09 1207 805 405 -107.-23 40 -91.5 -154 PC1s C s014 801 714 IIIB IVB VB VIB VIIB T工r IBIIB190*-70-112-30-100.9 CaClSeCl TiCl4 VC14 CrCl MnC12 FeCl CoCl2 Nicl CuCl2 ZnCl2 GaClaGeC14 AsCl SeCl4 2 约115 620 70782939 440d 824 672 100 430 283 77.9-49.5-8.9 209 TeCl4 a-Iel 2. /S 718875721437*204.7 194 500d475d500d45556858624673.4224 27.2 WCl AuC 27g 254d 2 645963860319 s216 24 550d763d 170d 430 501 231 4005 注:楠白考文献31,第4-41119页 *系在加压下。d表示分解。s表示升华。eC2、陆12、0sC2、BiC12的数据有个温度范围,本表系取平均值。 表7.3 氯化物的沸点(℃)
表 7.3 氯化物的沸点(℃)
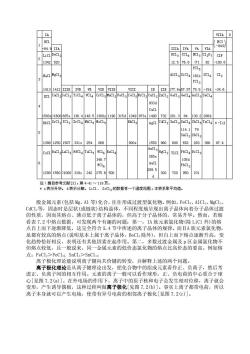
849 -849 IA IIIA IVA VA VIA 520 76 82 -100. C1 182 C12 1413141 IVB VB VIB VIIB B 77 75.5 -34.6 g33. 1190315d 1049973 a-Ie] 114. 79 012501507331s 254 268 960 600 652 28 97.4 H- 346.7 105 AnC] PbC1. 129015601000319s242275.650 302720 950 231 d 注:自参考文献[3],第4-41 119页 幸s表示升华,d表示分解。LiC1、ScC1的数据有一个温度范围,本表系取平均值。 般金屈元素(包括Mg、A1等)化合,往往形成过府型氨化物。例如,FC1,、A1C1,、MgC1 CdC1,等,周态时是层状(或链状)结构晶体,不同程度地呈现出离子晶体向着分子晶体过渡 的性质, 而其熔点 、沸点低 晶体的,但高于分子晶体的 常易升华。 然而, 若织 看表7.2中熔点数据,可发现两个有趣的问题:第一,IA族元素氯化物(除LiC1外) 点自上而下逐渐降低,这完全符合5.4节中所述的离子品体的规律。而LA族元素氨化物 虽都有较高的熔点(说明基本上属于离子品体,BC1,除外),但自上而下熔点逐渐升高,变 化趋热恰好相反, 表明还有其他因素在起作用。第二,多数过渡金属及 但熔点较低,且一般说来, 一金属元素的低价态氯化物的熔点比高价 例如 点:FeCl:>FeCl:SnC1:>SnCl. 离子极化理论能说明离子键向共价键的转变,并解释上述的两个问题。 离子极化理论是从离子键理论出发,把化合物中的组成元素看作正、负离子,然后考 虑正、负离子间的相互作用。元素的离子一般可以看作球形,正、负电荷的中心重合于球 心[见图7.2()]。在外电场的作用下,离子中的原子核和电子会发生相对位移,离子就会 变形 产生诱导偶极 这 种过程叫做离子极化 图7.2b)]。 事实上离子都带电荷,所以 离子本身就可以产生电场,使带有异号电荷的相邻离子极化[见图7.2(c)]
般金属元素(包括 Mg、Al 等)化合,往往形成过渡型氯化物。例如,FeCl3、AlCl2、MgCl2、 CdCl2等,固态时是层状(或链状)结构晶体,不同程度地呈现出离子晶体向着分子晶体过渡 的性质,因而其熔点、沸点低于离子晶体的,但高于分子晶体的,常易升华。然而,若细 看表 7.2 中熔点数据,可发现两个有趣的问题:第一,IA 族元素氯化物(除 LiCl 外)的熔 点自上而下逐渐降低,这完全符合 5.4 节中所述的离子晶体的规律。而ⅡA 族元素氯化物, 虽都有较高的熔点(说明基本上属于离子晶体,BeCl2除外),但自上而下熔点逐渐升高,变 化趋势恰好相反,表明还有其他因素在起作用。第二,多数过渡金属及 p 区金属氯化物不 但熔点较低,且一般说来,同一金属元素的低价态氯化物的熔点比高价态的要高。例如熔 点:FeCl2>FeCl3;SnCl2>SnCl4。 离子极化理论能说明离子键向共价键的转变,并解释上述的两个问题。 离子极化理论是从离子键理论出发,把化合物中的组成元素看作正、负离子,然后考 虑正、负离子间的相互作用。元素的离子一般可以看作球形,正、负电荷的中心重合于球 心[见图 7.2(a)]。在外电场的作用下,离子中的原子核和电子会发生相对位移,离子就会 变形,产生诱导偶极,这种过程叫做离子极化[见图 7.2(b)]。事实上离子都带电荷,所以 离子本身就可以产生电场,使带有异号电荷的相邻离子极化[见图 7.2(c)]

6o陆点 不學 6)离子在电 场中的极化 @项的 图7.2离子极化作用示意图 离子极化的结果,使正、负离子之间发生了额外的吸引力,甚至有可能使两个离子的 轨道或电子云产生变形而导致轨道的相互重叠,趋向于生 离子相互极化作用增强 ⊙⊙DC⊙ 团,演子健的装的示意园 成极性较小的键(见图7.3),即离子键向共价键转变。从这个观点看,离子键和共价 键之间并没有严格的界限,在两者之间存在着一系列过渡状态。例如,极性键可以看成是 离子键向共价键过渡的一种形式 离子极化作用的强弱与离子的极化力和变形性两方面因素有关 离子使其他离子极化而发生变形的能力叫做离子的极化力。离子的极化力决定于它的 电场强度,简单地说,主要决定于下列三个因素。 (1)离子的电荷电荷数越多,极化力越强。 (②)离子的半径半径越小,极化力越强。 (3)离子的外层电子构型外层8电子构型(稀有气体原子结构)的离子(如Na、Mg)极化 力弱, 外层9 7由 子构型的离子(如Cr”、M Fe”、Fe)以及外层18电子构型的离子(如 Cu、Zn)等极化力较强 离子的变形性(即离子可以被极化的程度)的大小也与离子的结构有关,主要也决定于 下列三个因素。 (1)离子的电荷随正电荷数的减少或负电荷数的增加,变形性增大。例如变形性 (②)离子的半径随半径的增大,变形性增大。例如变形性 F<C1<Br<I:0<S (3)离子的外层电子构型外层18,9~17等电子构型的离子变形性较大,具有稀有气体 外层电子构型的离子变形性较小。例如变形性 K'<Ag:Ca<Hg 根据上述规律,由于负离子的极化力较弱,正离子的变形性较小,所以考虑离子间极 化作用时, 一般说来,主要是考虑正离子的极化力引起负离子的变形。只有当正离子也容 易变形(如外层18电子构型的+1、+2价正离子)时,才不容忽视两种离子相互之间进一步 引起的极化作用(称之为附加极化效应),从而加大了总的离子极化作用。 离子极化理论是离子键理论的重要补充,由于离子极化作用引起雄的极性减少,使相 应的晶体会从离子型逐渐变成过渡型直至共价型(一般为分子晶体),因而往往会使晶体的 熔点降低、在水中 溶解度 减少 、颜色加深等。 离子极化对晶体结构和熔点等性质的影响,可以第3周期的氯化物为例,如表7.4所 示,由于Na、Mg、A1”、Si"的离子电荷依次递增而半径减小,极化力依次增强,引起C1 发生变形的程度也依次增大,致使正负离子轨道的重叠程度增大,键的极性减小,相应的 晶体由NaC1的离子晶体转变为层状的MgC1l2、AICl,的过渡型晶体,最后转变为SiCL,的共 价型分子晶体,其熔点、沸点、导电性也依次递减
离子极化的结果,使正、负离子之间发生了额外的吸引力,甚至有可能使两个离子的 轨道或电子云产生变形而导致轨道的相互重叠,趋向于生 成极性较小的键(见图 7.3),即离子键向共价键转变。从这个观点看,离子键和共价 键之间并没有严格的界限,在两者之间存在着一系列过渡状态。例如,极性键可以看成是 离子键向共价键过渡的一种形式。 离子极化作用的强弱与离子的极化力和变形性两方面因素有关。 离子使其他离子极化而发生变形的能力叫做离子的极化力。离子的极化力决定于它的 电场强度,简单地说,主要决定于下列三个因素。 (1)离子的电荷电荷数越多,极化力越强。 (2)离子的半径半径越小,极化力越强。 (3)离子的外层电子构型外层 8 电子构型(稀有气体原子结构)的离子(如 Na+、Mg2+)极化 力弱,外层 9~17 电子构型的离子(如 Cr3+、Mn2+、Fe2+、Fe3+)以及外层 18 电子构型的离子(如 Cu+、Zn2+)等极化力较强。 离子的变形性(即离子可以被极化的程度)的大小也与离子的结构有关,主要也决定于 下列三个因素。 (1)离子的电荷 随正电荷数的减少或负电荷数的增加,变形性增大。例如变形性 Si4+<Al3+<Mg2+<Na+<F -<O 2- (2)离子的半径 随半径的增大,变形性增大。例如变形性 F -<Cl-<Br-<I -;O 2-<S 2- (3)离子的外层电子构型外层 18,9~17 等电子构型的离子变形性较大,具有稀有气体 外层电子构型的离子变形性较小。例如变形性 K +<Ag+;Ca2+<Hg2+ 根据上述规律,由于负离子的极化力较弱,正离子的变形性较小,所以考虑离子间极 化作用时,一般说来,主要是考虑正离子的极化力引起负离子的变形。只有当正离子也容 易变形(如外层 18 电子构型的+1、+2 价正离子)时,才不容忽视两种离子相互之间进一步 引起的极化作用(称之为附加极化效应),从而加大了总的离子极化作用。 离子极化理论是离子键理论的重要补充,由于离子极化作用引起键的极性减少,使相 应的晶体会从离子型逐渐变成过渡型直至共价型(一般为分子晶体),因而往往会使晶体的 熔点降低、在水中溶解度减少、颜色加深等。 离子极化对晶体结构和熔点等性质的影响,可以第 3 周期的氯化物为例,如表 7.4 所 示,由于 Na+、Mg2+、Al3+、Si4+的离子电荷依次递增而半径减小,极化力依次增强,引起 Cl- 发生变形的程度也依次增大,致使正负离子轨道的重叠程度增大,键的极性减小,相应的 晶体由 NaCl 的离子晶体转变为层状的 MgCl2、AlCl3的过渡型晶体,最后转变为 SiCl4的共 价型分子晶体,其熔点、沸点、导电性也依次递减

表7.4第3周期中一些氯化物的性质 氯化物 MeCl2 AICI SiC14 正离 Na r+/mn 0.095 0.085 0.050 0.041 容点℃ 801 714 10加压下) -70 沸点/ 1413 1412 177.8升华) 57.57 摩尔电导率 熔点时) 尚大 很小 品体类型 离子品体层状结构品体层状结构品体 分子品体 对于前述的第Ⅱ主族及区、过渡金属的氯化物的熔点规律,可作 下解释 ,由于C1 负离子半径较大,有一定变形性,而第Ⅱ主族的Sr”、Ca”、Mg”、Be“的离子半径比同周期 的第I主族金属离子的半径要小得多,且电荷数为+2。因而正离子的极化力随之有所增强。 这就使得第Ⅱ主族金属的氯化物的晶体结构,随着极化作用的增强,自下而上,由BaC1: 的离子晶体逐渐转变为MgC1,的层状结构晶体或BeC1,的链状结构晶体(气态BeC1,是电偶极 矩为零的共价型分子)。BeCl、MgCl,可溶 于不少有机溶剂 甚至SrC1 也颇溶于酒精。 些都说明第Ⅱ主族金属的氯化物由于极化作用己有逐渐向分子晶体过渡的趋向。许多过波 金属及p区金属的氯化物,由于正离子电荷数较多,外层电子又可为9~17、或18等电了 构型,而可具有较强的极化力,使这些氯化物往往具有自离子型向分子型转变的过渡型品 体的结构,所以大多熔点、沸点比离子晶体的要低。而且由于较高价态“离子”电荷数较 多、半径较小,因而具有较强的极化力, 就易使其氯化物带有更多的共价性(易偏向分子品 体)。所以高价态金属氯化物比 的熔点、 点往往要低些 挥 性也要强 又如,AgCl、AgB、AgI颜色逐渐加深而在水中的溶解度却依次减少:同种元素的硫 化物的颜色常比相应的氧化物或氢氧化物的深等,都可从离子极化作用的增强得到解释。 3.氧化物 氧化物是指氧与电负性比氧的要小的元素所形成的二元化合物。人类在生产活动中大 量地使用各种氧化物,地壳中除氧外丰度较大的硅、铝、铁就以多种氧化物存在于自然界, 例如Si0,(石英砂 、A1:0( 土的主要组分) FeO和F 表7.5中列出了一些氧化物的熔点。氧化物的沸点的变化规律基本和熔点的一致,数 据不再列表:一些金属氧化物(包括Si0)的硬度见表7.6。总的说来,与氯化物相类似, 但也存在一些差异。金属性强的元素的氧化物如Na0、Ba0、Ca0、Mg0等是离子晶体,熔 ,大多数非金属元素的氧化物如S0 、N0、C0,等是共价型化合物,固态 等点 占低 但与所有的非金屈氯化物都是分子品体不同 非金属硅的氧化物Si0(方石英)是原子晶体(见图5.24),熔点、沸点较高。大多数金属性 不大强的元素的氧化物是过渡型化合物,其中一些较低价态金属的氧化物如Cr0、A10、 下e0、Ni0、Ti0,等可以认为是离子晶体向原子晶体的过渡,或者说介于离子晶体和原子品 体之间,熔点较高。而高价态金属的氧化物如V:0、CrO、MoO、M0,等,由于“金属离子” 与“氧离子”相互极化作用强烈,偏向于共价型分子晶
表 7.4 第 3 周期中一些氯化物的性质 对于前述的第Ⅱ主族及 p 区、过渡金属的氯化物的熔点规律,可作如下解释。由于 Cl- 负离子半径较大,有一定变形性,而第Ⅱ主族的 Sr2+、Ca2+、Mg2+、Be2+的离子半径比同周期 的第Ⅰ主族金属离子的半径要小得多,且电荷数为+2。因而正离子的极化力随之有所增强。 这就使得第Ⅱ主族金属的氯化物的晶体结构,随着极化作用的增强,自下而上,由 BaCl2 的离子晶体逐渐转变为MgCl2的层状结构晶体或BeCl2的链状结构晶体(气态BeCl2是电偶极 矩为零的共价型分子)。BeCl2、MgCl2可溶于不少有机溶剂,甚至 SrCl2也颇溶于酒精。这 些都说明第Ⅱ主族金属的氯化物由于极化作用已有逐渐向分子晶体过渡的趋向。许多过渡 金属及 p 区金属的氯化物,由于正离子电荷数较多,外层电子又可为 9~17、或 18 等电子 构型,而可具有较强的极化力,使这些氯化物往往具有自离子型向分子型转变的过渡型晶 体的结构,所以大多熔点、沸点比离子晶体的要低。而且由于较高价态“离子”电荷数较 多、半径较小,因而具有较强的极化力,就易使其氯化物带有更多的共价性(易偏向分子晶 体)。所以高价态金属氯化物比低价态的熔点、沸点往往要低些,挥发性也要强些。 又如,AgCl、AgBr、AgI 颜色逐渐加深而在水中的溶解度却依次减少;同种元素的硫 化物的颜色常比相应的氧化物或氢氧化物的深等,都可从离子极化作用的增强得到解释。 3.氧化物 氧化物是指氧与电负性比氧的要小的元素所形成的二元化合物。人类在生产活动中大 量地使用各种氧化物,地壳中除氧外丰度较大的硅、铝、铁就以多种氧化物存在于自然界, 例如 SiO2(石英砂)、Al2O3(粘土的主要组分)、Fe2O3和 Fe3O4等。 表 7.5 中列出了一些氧化物的熔点。氧化物的沸点的变化规律基本和熔点的一致,数 据不再列表;一些金属氧化物(包括 SiO2)的硬度见表 7.6。总的说来,与氯化物相类似, 但也存在一些差异。金属性强的元素的氧化物如 Na2O、BaO、CaO、MgO 等是离子晶体,熔 点、沸点大都较高。大多数非金属元素的氧化物如 SO2、N2O5、CO2等是共价型化合物,固态 时是分子晶体(见图 5.25),熔点、沸点低。但与所有的非金属氯化物都是分子晶体不同, 非金属硅的氧化物 SiO2(方石英)是原子晶体(见图 5.24),熔点、沸点较高。大多数金属性 不大强的元素的氧化物是过渡型化合物,其中一些较低价态金属的氧化物如 Cr2O3、Al2O3、 Fe2O3、NiO、TiO2等可以认为是离子晶体向原子晶体的过渡,或者说介于离子晶体和原子晶 体之间,熔点较高。而高价态金属的氧化物如 V2O5、CrO3、MoO3、Mn2O7等,由于“金属离子” 与“氧离子”相互极化作用强烈,偏向于共价型分子晶
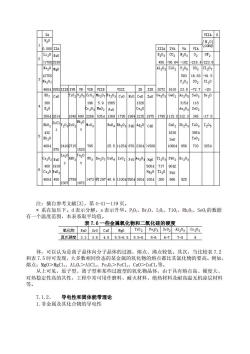
IITA IVA VA VIA 品 Li20B B203C02 20 218 223. 820M 203 S10 C20 50 -91. IIIE IVB VB VIB TI IB IIB 20721610 23.8 -72 58203 As205 r20 196 3 315d 118 K 261 8406902286535 13691795198412351975 1785115.0312.3 17.5 432 1630 395 400 795 25.51125d870230 0 733 875 152 20 400hg18 717 P0 400d450 300 88e 829 注:摘自参考文献[3],第4-41~119页。 *系在加压下。d表示分解。s表示升华。P0、Br0、I0、Ti0、h0、Se0的数据 有一个温度范围,本表系取平均值。 表7.6一些金属氧化物和二氧化硅的硬度 氧化物Be0Sr0Ca0M0 Ti02 Fepa Si02 Cr203 莫氏硬度3.33.84.55.5-6.55.5-65-66-77-99 体,可以认为是离子晶体向分子品体的过渡,熔点、沸点较低。其次,当比较表7.2 和表7.5时可发现,大多数相同价态的某金属的氧化物的熔点都比其氯化物的要高。例如, 熔点:Mg0>MgC12、A1,0>A1C1、Fe:0,>FeCl2、Cu0>CuC1,等。 从上可见,原子型、离子型和某些过渡型的氧化物晶体,由于具有熔点高、硬度大、 对热稳定性高的共性, 工程中常可用作磨料、耐火材料、绝热材料及耐高温无机涂层材料 7.1.2、 导电性和固体能带理论 1.非金属及其化合物的导电性
注:摘自参考文献[3],第 4-41~119 页。 * 系在加压下。d 表示分解。s 表示升华。P2O5、Br2O、I2O5、TiO2、Rh2O3、SeO2的数据 有一个温度范围,本表系取平均值。 表 7.6 一些金属氧化物和二氧化硅的硬度 体,可以认为是离子晶体向分子晶体的过渡,熔点、沸点较低。其次,当比较表 7.2 和表 7.5 时可发现,大多数相同价态的某金属的氧化物的熔点都比其氯化物的要高。例如, 熔点:MgO>MgCl2、Al2O3>AlCl3、Fe2O3>FeCl3、CuO>CuCl2等。 从上可见,原子型、离子型和某些过渡型的氧化物晶体,由于具有熔点高、硬度大、 对热稳定性高的共性,工程中常可用作磨料、耐火材料、绝热材料及耐高温无机涂层材料 等。 7.1.2、 导电性和固体能带理论 1.非金属及其化合物的导电性

如6.1节所述,金属导体、半导体和绝缘体的主要差别在于电导率的大小。导体非常 容易导电,电导率很大,一般大于10S·m:绝缘体很难,以致全然不导电,电导率小于 10S·m:而半导体则介于中间,电导率为10~10S·m。 非金属单质中,位于周期表p区右上部的元素(如C1 0)及稀有气体元素(如Ne、Ar) 的单质为绝缘体, 位于周期表P区对角线附近的元素单质大都具有半导体的性质(见图 6.7),其中硅和锗是公认最好的,其次是硒,其他半导体单质各有缺点。例如,碘的蒸气 压大、期的塔点高、磷有毒等,因而应用不多。位于周期表左边的大多数金属及其合金是 导体,己在6.1节中讨论过。 非金屈元素的化合物 大多数离子品体(如 CC1)都是绝缘 些无机化合物和 的化合物半 导体是所谓IⅢ-V(主)族化合物,以及IⅡ-Ⅵ族化合物,如GaAs、InSb、GaP以及如Zn0、 CdS、ZnSe等。此外,Sn0.、PbS、PbSe等也是应用较多的半导体。 若把一些化合物半导体看成是由单质半导体衍生而来,则有助于了解半导体的化学键。 例如可从下列实例中看出 GeGe→GaAs→ZnSe →CuB (IV-IV) (-V) (II-) 这些具有8个价电子①的半导体的化学键,是共价键或共价键与离子键(不是金属键:) 之间的过渡键型(或者说,半导体的化学键除G©、Si等少数共价键外,大多可以看成是由 于极化而引起由离子键向共价键过渡而形成的键)。 与金属的导申洁况不同.大多数半导体、饰缘体的申导率浦温府升高而讯速幽加。这 是由于导电本 不同而引起的 半导体通常是由于热激发(见7.3节)产生价电子和空穴而 导电,金属则是由于自由电子的存在而导电。 作为单质半导体的材料要求有很高的纯度。例如,半导体锗的纯度要在99.999999%(8 个“9”)以上。但有时却要掺入少量杂质以改变半导体的导电性能。恰当地掺入某种微量 杂质(即杂)会大大增加半导体的导由件,这是半导休不同干金匠的另一个重要特征。半 导体硅和储中最常用的掺杂元素是第V主族元素磷、 砷、锑和第Ⅲ主旋元素硼等。藉此可 以制成各种半导体器件,将在7.3节中讨论。 2.固体能带理论 金属、半导体和其他许多固体的电子结构可以用固体能带理论来描述。下面介绍的是 以分子轨道理论为基础发展昆来的固体能带理论。它可以解释金匠自由申子模型所不能说 明的许多实验规律和事实。例如,固体材料为何有导体、半导体和绝缘体之分,半导体为 何具有与导体不同的特性 以钠为例,如果两个钠原子形成N分子,按照分子轨道理论,若不考虑内层电子① 两个3s原子轨道可组合形成两个分子轨道:一个能量较低的成键分子轨道和一个能量较高 的反键分子轨道。当原子数增加到很大数目时,由此组合的相应的分子轨道数也很大, 这些分子轨道的能级之间相差极小,几乎连成一片,形成了具有一定上限和下限的能带, 如图7.4 这样,在金属钠晶体中 3s原子轨道之间的相互作用 轨道的能 级发生了分裂,形成3s能带。对于1mo1Na金属,在3s能带中有N(阿佛加德罗常数)个分 子轨道,按泡利不相容原理可容纳2N个电子。而1 molNa金属只有N个电子,只能充满3s 能带中能级较低的一半分子轨道,其他一半是空的。此时,3s能带是未满的能带,简称未 满带,如图7.5(a)左图。 金属晶体中存在这种未满的能带是金属能导电的根本原因。未满带中的电子在外界电 场影响下,并不需要消耗多少能量即能跃入该未满带的空的分子轨道中去,使金属具有导 电性
如 6.1 节所述,金属导体、半导体和绝缘体的主要差别在于电导率的大小。导体非常 容易导电,电导率很大,一般大于 10S·m -1;绝缘体很难,以致全然不导电,电导率小于 10-11S·m -1;而半导体则介于中间,电导率为 10-11~10S·m -1。 非金属单质中,位于周期表 p 区右上部的元素(如 Cl2、O2)及稀有气体元素(如 Ne、Ar) 的单质为绝缘体,位于周期表 p 区对角线附近的元素单质大都具有半导体的性质(见图 6.7),其中硅和锗是公认最好的,其次是硒,其他半导体单质各有缺点。例如,碘的蒸气 压大、硼的熔点高、磷有毒等,因而应用不多。位于周期表左边的大多数金属及其合金是 导体,已在 6.1 节中讨论过。 非金属元素的化合物中,大多数离子晶体(如 NaCl、KCl、CaO 在固态时)和分子晶体(如 CO2、CCl4)都是绝缘体。一些无机化合物和某些有机化合物是半导体。应用最广的化合物半 导体是所谓Ⅲ-Ⅴ(主)族化合物,以及Ⅱ-Ⅵ族化合物,如 GaAs、InSb、GaP 以及如 ZnO、 CdS、ZnSe 等。此外,SnO2、PbS、PbSe 等也是应用较多的半导体。 若把一些化合物半导体看成是由单质半导体衍生而来,则有助于了解半导体的化学键。 例如可从下列实例中看出: GeGe→GaAs→ZnSe→CuBr (Ⅳ-Ⅳ) (Ⅲ-Ⅴ) (Ⅱ-Ⅵ) (Ⅰ-Ⅶ) 这些具有 8 个价电子①的半导体的化学键,是共价键或共价键与离子键(不是金属键!) 之间的过渡键型(或者说,半导体的化学键除 Ge、Si 等少数共价键外,大多可以看成是由 于极化而引起由离子键向共价键过渡而形成的键)。 与金属的导电情况不同,大多数半导体、绝缘体的电导率随温度升高而迅速增加。这 是由于导电本质不同而引起的,半导体通常是由于热激发(见 7.3 节)产生价电子和空穴而 导电,金属则是由于自由电子的存在而导电。 作为单质半导体的材料要求有很高的纯度。例如,半导体锗的纯度要在 99.999999%(8 个“9”)以上。但有时却要掺入少量杂质以改变半导体的导电性能。恰当地掺入某种微量 杂质(即掺杂)会大大增加半导体的导电性,这是半导体不同于金属的另一个重要特征。半 导体硅和锗中最常用的掺杂元素是第 V 主族元素磷、砷、锑和第Ⅲ主旋元素硼等。藉此可 以制成各种半导体器件,将在 7.3 节中讨论。 2.固体能带理论 金属、半导体和其他许多固体的电子结构可以用固体能带理论来描述。下面介绍的是 以分子轨道理论为基础发展起来的固体能带理论。它可以解释金属自由电子模型所不能说 明的许多实验规律和事实。例如,固体材料为何有导体、半导体和绝缘体之分,半导体为 何具有与导体不同的特性等。 以钠为例,如果两个钠原子形成 Na2分子,按照分子轨道理论,若不考虑内层电子①, 两个 3s 原子轨道可组合形成两个分子轨道:一个能量较低的成键分子轨道和一个能量较高 的反键分子轨道。当原子数增加到很大数目 n 时,由此组合的相应的分子轨道数也很大, 这些分子轨道的能级之间相差极小,几乎连成一片,形成了具有一定上限和下限的能带, 如图 7.4 所示。这样,在金属钠晶体中,由于 3s 原子轨道之间的相互作用,3s 轨道的能 级发生了分裂,形成 3s 能带。对于 1molNa 金属,在 3s 能带中有 NA(阿佛加德罗常数)个分 子轨道,按泡利不相容原理可容纳 2NA个电子。而 1molNa 金属只有 NA个电子,只能充满 3s 能带中能级较低的一半分子轨道,其他一半是空的。此时,3s 能带是未满的能带,简称未 满带,如图 7.5(a)左图。 金属晶体中存在这种未满的能带是金属能导电的根本原因。未满带中的电子在外界电 场影响下,并不需要消耗多少能量即能跃入该未满带的空的分子轨道中去,使金属具有导 电性

彐空能领}3能带 12 3.·以] 原子数 图.4全厘钠中35能带形成示意图 又如,镁的3s能带是全充满的,如图7.5(a)右图,这种能带叫做满带。满带中没有 空轨道,似乎不能导电。但镁的3s能带和3即能带发生部分重叠,3即能带原应是一个没有 电子占据的空带,然而有部分3S能带中的电子 实际上也进入3能带 一个满带和一个空 带相互重叠的结果好像连接成一个范围较大的未满带一样,所以镁和其他碱土金属都是良 导体。 空能级 空带 ■被用未清带 了满带 ①未满的能带 ②满蒂和空帮的部分重叠 ()导体 □}空带☐}空带 带 }禁带 }满带 带 6)半导体 (c)绝缘体 图7.5导体、半导体和绝缘体的能带根型示意图 导体、半导体、绝缘体的能带中电子分布的情况各具有明显的特征,如图7.5所示 导体中存在未满带(由于电子未充满或能带重叠)。绝缘体的特征是价电子所处的能带都是 满带,且满带与相邻的空带之间存在一个较宽的禁带。例如,绝缘体金刚石禁带的能隙(E 为5.2V①(或500kJ·mo1),是个典型的绝缘体。半导体的能带与绝缘体的相似,但半导 体的禁带要狭窄得多(一般在1eV左右)。例如,半导体硅和储的禁带的能隙分别为1.12V 和0.67eV. 典型的半导体硅和者品体存在若另一种能带重吾情祝。品体硅和诺都是金风则石型结构」 每个原子以4个sp杂化轨道成 ,并形成两 可容纳4N 电子的能带 能级较低的 带为满带,能级较高的能带为空,其间同隔若已较小的禁。因而其有典型半导体的能 带结构。 金属的导电主要是通过未满带中的电子来实现的。温度上升时,由于金属中原子和离 子的热振动加剧,电子与它们碰撞的颜率增加,电子穿越晶格的运动受阻,从而导电能力 降低。因此金属电导率随温度升 高而有所下降。绝缘体不能 导电主要是因为禁带的宽度较 般都大于 eV,在一般温度下电了 半导体则由 于带 度较小,一般均小于2~3V,虽然在很低温度时不能导电,但当升高至适当温度(例如室 温)时就可有少数电子藉热激发,跃过禁带而导电。因此,根据能带理论可以说明导体、半 导体和绝缘体导电性的区别 应当指出,绝缘体与半导体的区别不是绝对的。绝缘体在通常情况下是不导电的,但 在相当高的温度或高的电压下, 满带中的电子可能跃过较宽的禁带 而使绝缘体变为半导 体。值得注意,零族元素单质(稀有气体)在高电压下,由于原子中电 子被激发而能导电, 并能发出各种颜色的光,广泛应用于电光源制造。例如,日光灯管是将汞和氩气充入玻璃
又如,镁的 3s 能带是全充满的,如图 7.5(a)右图,这种能带叫做满带。满带中没有 空轨道,似乎不能导电。但镁的 3s 能带和 3p 能带发生部分重叠,3p 能带原应是一个没有 电子占据的空带,然而有部分 3s 能带中的电子实际上也进入 3p 能带。一个满带和一个空 带相互重叠的结果好像连接成一个范围较大的未满带一样,所以镁和其他碱土金属都是良 导体。 导体、半导体、绝缘体的能带中电子分布的情况各具有明显的特征,如图 7.5 所示。 导体中存在未满带(由于电子未充满或能带重叠)。绝缘体的特征是价电子所处的能带都是 满带,且满带与相邻的空带之间存在一个较宽的禁带。例如,绝缘体金刚石禁带的能隙(Eg) 为 5.2eV①(或 500kJ·mol-1 ),是个典型的绝缘体。半导体的能带与绝缘体的相似,但半导 体的禁带要狭窄得多(一般在 1eV 左右)。例如,半导体硅和锗的禁带的能隙分别为 1.12eV 和 0.67eV。 典型的半导体硅和锗晶体存在着另一种能带重叠情况。晶体硅和锗都是金刚石型结构, 每个原子以 4 个 sp 3杂化轨道成键,并形成两组均可容纳 4NA个电子的能带,能级较低的能 带为满带,能级较高的能带为空带,其间间隔着 EA较小的禁带。因而具有典型半导体的能 带结构。 金属的导电主要是通过未满带中的电子来实现的。温度上升时,由于金属中原子和离 子的热振动加剧,电子与它们碰撞的频率增加,电子穿越晶格的运动受阻,从而导电能力 降低。因此金属电导率随温度升高而有所下降。绝缘体不能导电主要是因为禁带的宽度较 大,一般都大于 5eV,在一般温度下电子难以藉热运动而跃过禁带。半导体则由于禁带宽 度较小,一般均小于 2~3eV,虽然在很低温度时不能导电,但当升高至适当温度(例如室 温)时就可有少数电子藉热激发,跃过禁带而导电。因此,根据能带理论可以说明导体、半 导体和绝缘体导电性的区别。 应当指出,绝缘体与半导体的区别不是绝对的。绝缘体在通常情况下是不导电的,但 在相当高的温度或高的电压下,满带中的电子可能跃过较宽的禁带,而使绝缘体变为半导 体。值得注意,零族元素单质(稀有气体)在高电压下,由于原子中电子被激发而能导电, 并能发出各种颜色的光,广泛应用于电光源制造。例如,日光灯管是将汞和氩气充入玻璃
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第六章 元素化学与无机材料.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第五章 物质结构基础.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第四章 电化学与金属腐蚀.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第三章 水化学与水污染.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第二章 化学反应基本原理与大气污染.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第一章 热化学与能源.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)绪论.pdf
- 内蒙古科技大学:《普通化学》课程教学大纲 General Chemistry.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第18章 其他分离分析法.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第17章 高效液相色谱分析法(High Pertormance Liquid Chromatography,HPLC).pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第16章 气相色谱法.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第15章 分离分析法导论.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第14章 其他电化学分析法.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第10章 质谱分析法 Mass Spectrometry,MS.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第13章 极谱伏安分析法简介.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第12章 电位分析法.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第11章 电化学分析法导论.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第9章 其他光谱法.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第8章 核磁共振波谱法.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第7章 分子发光分析法.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验一 酸碱标准溶液的比较滴定.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验二 酸碱标准溶液的配制与浓度标定.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验三 混合碱样的分析(双指示剂法).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验四 醋酸解离度与解离常数的测定.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验五 电离平衡和沉淀反应.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验六 水的硬度测定.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验七 氧化还原反应.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验八 由粗食盐制备试剂级氯化钠.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验九 无机化合物性质实验.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验十一 硫酸亚铁铵的制备.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验十二 含铬废液的处理.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷1(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷1(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷2(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷2(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷3(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷3(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷4(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷4(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷5(答案).pdf
