内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验四 醋酸解离度与解离常数的测定

实验四醋酸解离度与解离常数的测定 “、实验目的 (1)测定弱酸解离度和解离常数。 (2)学习使用酸度计并掌握其使用技术。 (3)熟练滴定技术和溶液的稀释。 二、实验原理 醋酸(HAc)是弱电解质,在水溶液中存在下列解离平衡 HAc+H2O=H3O++Ac 若C为HAc的起始浓度,a为解离度,则平衡时:a=H中VC 因而H=aC,Ac]=aC:HAc=C-aC, K。=Ca21-a:当a<5%,KmCa2 根据pH=lgH知,只要测定已知浓度HAc溶液的PH值,就可以计算它的解离度和解离常数, 三、实验仪器和试剂 移液管1支(25.00mL)、碱式滴定管(50.00ml)、维形瓶2个(250ml)、容量瓶3个 (50.00ml)、烧杯4个(100ml)、酸度计、温度计。 HAc(0.2molL)、NaOH标准溶液(O.2molL)、酚酞指示剂、标准缓冲溶液(pH=4.00,25℃) 四、实验步骤 (1)醋酸溶液浓度的标定 用移液管移取25.00ml待标定的醋酸溶液于锥形瓶中,加入酚酞指示剂2~3滴.用NaOH标准溶液滴 定至刚出现微红色,摇动后约半分钟不褪色为止,在表1中记下NaOH标准溶液的初体积和终体积。 平行滴定两次,并计算醋酸溶液的浓度。 (2)配制不同浓度的醋酸溶液 将三只50.00ml容量瓶编成1~3号,用刻度吸量管移取2.50ml、5.00ml、25.00ml己标定的醋酸溶 液定容于50.00ml三只容量瓶中,并计算浓度值填入表2。加上已标定的H4c溶液共有四种不同浓度的 溶液。 仔)测定HAc溶液的PH值 将上述四种浓度的HAc溶液分置于四只干燥的1OOml烧杯中,按由稀到浓的次序在酸度计上分别 测定四种浓度醋酸溶液的PH值,在表2中记录数据和温度,并计算醋酸的解离度与解离常数。 五、思考讨论题 (I)改变所测HAc溶液的浓度或温度,则解离度和解离常数有无变化?若有变化,将会怎样变 化? (2)若所用HAc溶液的浓度极稀,是否能用K=uC求解离常数?为什么? (3)使用酸度计测溶液的pH值的操作步骤有哪些? 表1.醋酸溶液浓度测定数据:CHAc VHAC-CNaOH'VNaoH 滴定序号 所取醋酸溶的体积VHAc,ml 25.00 25.00 NaOH滴定初体积,ml NaOH滴定终体积ml 消耗的NaOH体积VNaOH,-ml
实验四 醋酸解离度与解离常数的测定 一、实验目的 (1) 测定弱酸解离度和解离常数。 (2) 学习使用酸度计并掌握其使用技术。 (3) 熟练滴定技术和溶液的稀释。 二、实验原理 醋酸(HAc)是弱电解质,在水溶液中存在下列解离平衡: HAc+H2O = H3O ++Ac- 若C为HAc的起始浓度,α为解离度,则平衡时:α=[H+ ]/C 因而 [H+ ]=αC; [Ac- ]=αC; [HAc]=C-αC, Kα=Cα2 /1-α;当α<5%,Kα=Cα2 根据pH= -lg[H+ ]知,只要测定已知浓度HAc溶液的PH值,就可以计算它的解离度和解离常数。 三、实验仪器和试剂 移液管1支(25.00mL)、碱式滴定管(50.00ml)、锥形瓶2个(250ml)、容量瓶3个 (50.00ml)、烧杯4个(100ml)、酸度计、温度计。 HAc(0.2mol/L)、NaOH标准溶液(0.2mol/L)、酚酞指示剂、标准缓冲溶液(pH=4.00,25℃) 四、实验步骤 (1)醋酸溶液浓度的标定 用移液管移取25.00ml待标定的醋酸溶液于锥形瓶中,加入酚酞指示剂2~3滴,用NaOH标准溶液滴 定至刚出现微红色,摇动后约半分钟不褪色为止,在表1中记下NaOH标准溶液的初体积和终体积。 平行滴定两次,并计算醋酸溶液的浓度。 (2)配制不同浓度的醋酸溶液 将三只50.00ml容量瓶编成1~3号,用刻度吸量管移取2.50ml、5.00ml、25.00ml已标定的醋酸溶 液定容于50.00ml三只容量瓶中,并计算浓度值填入表2。加上已标定的HAc溶液共有四种不同浓度的 溶液。 (3)测定HAc溶液的PH值 将上述四种浓度的HAc溶液分置于四只干燥的100ml烧杯中,按由稀到浓的次序在酸度计上分别 测定四种浓度醋酸溶液的PH值,在表2中记录数据和温度,并计算醋酸的解离度与解离常数。 五、思考讨论题 (1)改变所测HAc溶液的浓度或温度,则解离度和解离常数有无变化?若有变化,将会怎样变 化? (2)若所用HAc溶液的浓度极稀,是否能用Ka=α2C求解离常数?为什么? (3)使用酸度计测溶液的pH值的操作步骤有哪些? 表1.醋酸溶液浓度测定数据: CHAc ·VHAc=CNaOH·VNaOH 滴定序号 Ⅰ Ⅱ 所取醋酸溶的体积VHAc ,ml 25.00 25.00 NaOH滴定初体积,ml NaOH滴定终体积,ml 消耗的NaOH体积VNaOH,ml
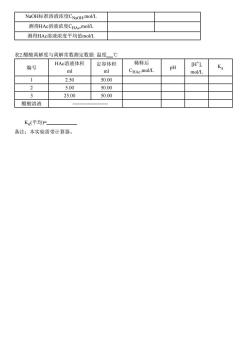
NaOH标准溶液浓度CNaOH,mol/L 测得HAc溶液浓度CHAc,mol/L 测得HAc溶液浓度平均值mol/L 表2.酷酸离解度与离解常数测定数据:温度℃ HAc溶液体积 定容体积 稀释后 编号 H门 1 pH m CHAe.mol/L mol/L 2.50 50.00 2 5.00 50.00 3 25.00 50.00 醋酸溶液 K(平均)= 备注:本实验需带计算器
NaOH标准溶液浓度CNaOH,mol/L 测得HAc溶液浓度CHAc ,mol/L 测得HAc溶液浓度平均值mol/L 表2.醋酸离解度与离解常数测定数据: 温度 ℃ 编号 HAc溶液体积 ml 定容体积 ml 稀释后 CHAc ,mol/L pH [H+ ], mol/L Ka 1 2.50 50.00 2 5.00 50.00 3 25.00 50.00 醋酸溶液 - Kα (平均)= 备注:本实验需带计算器
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验三 混合碱样的分析(双指示剂法).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验二 酸碱标准溶液的配制与浓度标定.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验一 酸碱标准溶液的比较滴定.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第七章 高分子化合物与材料.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第六章 元素化学与无机材料.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第五章 物质结构基础.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第四章 电化学与金属腐蚀.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第三章 水化学与水污染.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第二章 化学反应基本原理与大气污染.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)第一章 热化学与能源.pdf
- 内蒙古科技大学:《普通化学》课程授课教案(讲义)绪论.pdf
- 内蒙古科技大学:《普通化学》课程教学大纲 General Chemistry.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第18章 其他分离分析法.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第17章 高效液相色谱分析法(High Pertormance Liquid Chromatography,HPLC).pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第16章 气相色谱法.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第15章 分离分析法导论.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第14章 其他电化学分析法.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第10章 质谱分析法 Mass Spectrometry,MS.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第13章 极谱伏安分析法简介.pdf
- 《现代分析仪器技术》课程教学资源(PPT课件)第12章 电位分析法.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验五 电离平衡和沉淀反应.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验六 水的硬度测定.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验七 氧化还原反应.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验八 由粗食盐制备试剂级氯化钠.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验九 无机化合物性质实验.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验十一 硫酸亚铁铵的制备.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(实验指导)实验十二 含铬废液的处理.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷1(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷1(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷2(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷2(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷3(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷3(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷4(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷4(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷5(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷6(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷5(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷6(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷7(答案).pdf
