西北大学:《中级无机化学》课程教学课件(专题讲稿)16 晶格能及其应用(PPT)

晶格能及其应用 晶格能的定义 晶格能又称点阵能。被定义为在OK、1个标准压力下, 1ol离子晶体转化成相互无限远离的气态离子时内能的变化值, 用符号L,表示。 (1mol)MX-Mm(g)+nx-(g) L=△U一般地,为了方便,设L=L。 设此过程中的焓变为△H6△H=△U+△n(g)RT 根据前面所述,对于实验化学家来说,焓和能的概念是严 格区分的,但数据上是混淆使用的,因此可将上式中的△(g)RT 忽略。于是 △H≈△U9=L≈Lo 需要指出的是,在有些书中,将晶格能定义为一组互相远离的气态离子,按 规则的晶体排列起来构成1mo1离子晶体时所释放的能量。但是按照文献提供的或 理论计算的晶格能数据都是正值,而按这种定义得到的符号与热力学习惯相反。 这种矛盾,很多人注意到了,为此为了与$的单位一致,国外的书现在一般都采 用前述定义,而在我们国家,不知什么原因,至今仍有不少人使用后面的定义
一 晶格能的定义 晶格能及其应用 晶格能 又称点阵能。被定义为在0K、1个标准压力下, 1mol离子晶体转化成相互无限远离的气态离子时内能的变化值, 用符号L0表示。 (1mol) MXn Mn+(g)+nX-(g) L0 =△U0 θ 一般地,为了方便,设LT =L0 设此过程中的焓变为△HT θ △HT θ=△UT θ+△n(g)RT 根据前面所述,对于实验化学家来说,焓和能的概念是严 格区分的,但数据上是混淆使用的,因此可将上式中的△n(g)RT 忽略。于是 △HT θ≈△Ut θ=LT ≈L0 需要指出的是,在有些书中,将晶格能定义为一组互相远离的气态离子,按 规则的晶体排列起来构成1mol离子晶体时所释放的能量。但是按照文献提供的或 理论计算的晶格能数据都是正值,而按这种定义得到的符号与热力学习惯相反。 这种矛盾,很多人注意到了,为此为了与SI的单位一致,国外的书现在一般都采 用前述定义,而在我们国家,不知什么原因,至今仍有不少人使用后面的定义

晶格能是离子晶体中离子间结合力大小的一个量度。晶格能 越大,表示离子晶体越稳定,破坏其晶体耗能越多。我们知道离 子晶体间存在着离子间的静电引力,因此,晶格能本质上是离子 间静电引力大小的量度。 离子化合物的晶格能一般都比较大,这是由于离子间有强烈 的静电引力之故。较大的晶格能意味着离子间结合紧密,这样的 离子化合物其熔点和硬度必定很高。事实上,高熔点、高硬度就 是离子化合物的显著特征。 既然是静电引力,可以想象,正负离子的电荷越高,核间距 离越小,静电引力就越大,晶格能就越大。相应地,其熔点、硬 度就越大,这就是如Mg0、CaO以及Al,O,常被用来作高温材料 和磨料的原因。 既然是静电引力,可以预料,不同类型的离子晶体,如 NaC1型,配位数为6;CsCI型,配位数为8;ZnS型,配位数为4。 这些离子晶体的一种离子周围有不同数目的异号离子在相互作用, 其间的静电作用力显然是不一样的。事实上,在后面我们将看到, 不同类型的晶体,有不同的马德隆常数值,从而有不同的晶格能 数据
晶格能是离子晶体中离子间结合力大小的一个量度。晶格能 越大,表示离子晶体越稳定,破坏其晶体耗能越多。我们知道离 子晶体间存在着离子间的静电引力,因此,晶格能本质上是离子 间静电引力大小的量度。 离子化合物的晶格能一般都比较大,这是由于离子间有强烈 的静电引力之故。较大的晶格能意味着离子间结合紧密,这样的 离子化合物其熔点和硬度必定很高。事实上,高熔点、高硬度就 是离子化合物的显著特征。 既然是静电引力,可以想象,正负离子的电荷越高,核间距 离越小,静电引力就越大,晶格能就越大。相应地,其熔点、硬 度就越大,这就是如MgO、CaO以及Al2O3常被用来作高温材料 和磨料的原因。 既然是静电引力,可以预料,不同类型的离子晶体,如 NaCl型,配位数为6;CsCl型,配位数为8;ZnS型,配位数为4。 这些离子晶体的一种离子周围有不同数目的异号离子在相互作用, 其间的静电作用力显然是不一样的。事实上,在后面我们将看到, 不同类型的晶体,有不同的马德隆常数值,从而有不同的晶格能 数据
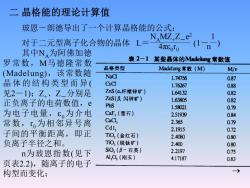
二晶格能的理论计算值 玻恩一朗德导出了一个计算晶格能的公式: NMZZ_e2 对于二元型离子化合物的晶体L= 其中NA为阿佛加德 4IEoTo 罗常数,M马德隆常数 表2-1某些晶体的Madelng常数值 晶格类型 (Madelung),该常数随 Madelung常数(M) M/v NaC 1.74756 087 晶体的结构类型而异( CsC 1.76267 0.88 见2-1);Z、Z_分别是 ZnS(a,纤维锌矿) 1.64132 0.82 正负离子的电荷数值,e ZnS(B闪锌矿) 1.63805 0.82 PbS 1.58021 0.79 为电子电量,8。为介电 CaF,(萤石) 251939 0.84 常数,【,为相邻异号离 CaCl, 2.365 0.79 CdI, 子间的平衡距离,即正 2.1915 0.72 TO,(金红石) 2.4080 0.80 负离子半径之和。 TO,(锐钛矿) 2.400 0.80 n为玻恩指数(见下 Si0,(B-石英) 2.2197 0.75 A1,O3(刚玉) 4.17187 0.83 页表2.2),随离子的电子 构型而变化; →
二 晶格能的理论计算值 NAMZ+Z-e 2 1 4π0 r 0 n 玻恩-朗德导出了一个计算晶格能的公式: 对于二元型离子化合物的晶体 L= (1- ) 其中NA为阿佛加德 罗常数,M马德隆常数 (Madelung),该常数随 晶体的结构类型而异( 见2-1);Z+、Z-分别是 正负离子的电荷数值,e 为电子电量,0为介电 常数,r 0为相邻异号离 子间的平衡距离,即正 负离子半径之和。 n为玻恩指数(见下 页表2.2),随离子的电子 构型而变化; →
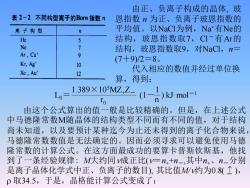
由正、负离子构成的晶体,玻 表2-2不同构型离子的Born指数N 恩指数n为正、负离子玻恩指数的 离子构型 n 平均值。以NaCI为例,Na有Ne的 He 5 结构,玻恩指数取7,CI一有Ar的 e 7 结构,玻恩指数取9,对NaCl,n= Ar,Cu' 9 (7+9)/2=8。 Kr,Ag' 10 Xe,Au' 代入相应的数值并经过单位换 12 算,得到: Lo= 389×10w.Z-(1h)Umo- 由这个公式算出的值一般是比较精确的。但是,在上述公式 中马德隆常数M随晶体的结构类型不同而有不同的值,对于结构 尚未知道,以及要预计某种迄今为止还未得到的离子化合物来说 马德隆常数数值是无法确定的。因而必须寻求可以避免使用马德 隆常数的计算公式。在这方面最成功的要算卡普斯软斯基,他找 到了一条经验规律:M大约同y成正比(v=n4+n-,其中n、n-分别 是离子晶体化学式中正、负离子的数目),其比值M约为0.8(个), p取34.5,于是,晶格能计算公式变成了:
1.389×105MZ+Z- 1 r 0 n L0 = (1- ) kJ·mol-1 由这个公式算出的值一般是比较精确的。但是,在上述公式 中马德隆常数M随晶体的结构类型不同而有不同的值,对于结构 尚未知道,以及要预计某种迄今为止还未得到的离子化合物来说, 马德隆常数数值是无法确定的。因而必须寻求可以避免使用马德 隆常数的计算公式。在这方面最成功的要算卡普斯钦斯基,他找 到了一条经验规律: M大约同成正比(=n++n-,其中n+、n-分别 是离子晶体化学式中正、负离子的数目), 其比值M/约为0.8( ), 取34.5,于是,晶格能计算公式变成了: 由正、负离子构成的晶体, 玻 恩指数 n 为正、负离子玻恩指数的 平均值。以NaCl为例,Na+有Ne的 结构,玻恩指数取7,Cl-有Ar的 结构,玻恩指数取9,对NaCl,n= (7+9)/2=8。 代入相应的数值并经过单位换 算,得到:

L0-1214×10××Z4 (1-34.5/m) 上式还可简化为: Lo=1.079×105×v× ZZ. ro 加上精确式 1389X10ZZ-(1-2Wmol1 Lo= 所以,晶格能共有三个计算公式
L0= 1.214×105× × (1-34.5/r0 ) Z+Z- r0 上式还可简化为: L0= 1.079×105× × Z+Z- r0 1.389×105MZ+Z- 1 r 0 n L0= (1- ) kJ·mol-1 加上精确式 所以,晶格能共有三个计算公式

分别以这三个公式计算NaCl的晶格能有 L,=1389×10xM×Z:71-1m =1.389×105×1.748×1×1(1-1/8)/276 =770 kJmol-1 L0=1.214×105××Z+Z (1-34.5/mo) =1.214×105×2×1×P1-34.5/276)/276 =770kJ-mol-1 L0=1.079×105×xZ+Z =1.079×105×2×1×1/276 =782 kJmol-1 结果十分相近
分别以这三个公式计算NaCl的晶格能有 结果十分相近。 L0 = 1.389×105×M× (1-1/n) =1.389×105×1.748×1×1(1-1/8)/276 =770 kJmol-1 Z+Z- r0 L0 =1.079×105× × =1.079×105×2×1×1/276 =782 kJmol-1 Z+Z- r0 L0 = 1.214×105×× (1-34.5/r0 ) =1.214×105×2×1×1(1-34.5/276)/276 =770kJmol-1 Z+Z- r0

三晶格能的实验确定 仍以NaCI为例,先设计一个包括晶格能的热力学循环。 NaCl(s) Na+(g)+ CI(g) L 个I 个Ea Na(g) Ci(g) -△Hm9 ↑S 个1/2B Na(s) 1/2Cl2(g L=(S+INa+(1/2 B+Ea)CI-AHm 0 这个热力学循环,称为玻恩-哈伯热化学循环(Bom-Haber Cycle), 显然这个循环的理论基础是盖斯定律。 代入相应的热力学数据,有 L=108.7+496+121.7-368.5+411=769kJmo1 与前面理论计算的结果一致 这样由热力学数据求算出来的值称为晶格能实验值
三 晶格能的实验确定 仍以NaCl为例,先设计一个包括晶格能的热力学循环。 NaCl(s) Na+(g) + Cl-(g) L I Ea Na(g) + Cl(g) -△fHm S 1/2 B Na(s) + 1/2 Cl2 (g) 这个热力学循环,称为玻恩-哈伯热化学循环(Born-Haber Cycle), 显然这个循环的理论基础是盖斯定律。 与前面理论计算的结果一致 L = 108.7+496+121.7-368.5+411=769 kJmol-1 代入相应的热力学数据,有 L =(S+I)Na+(1/2 B+Ea)Cl-△fHm 这样由热力学数据求算出来的值称为晶格能实验值

四晶格能在无机化学中的应用 1计算假想化合物的生成焓 例如,从Cr原子的价层结构3d54s来看,C失去1个4s电子后成为3d5半充 满构型。这种结构似应是稳定的,因而似应有CX(X=F、CI、Br、D化合物 存在,但实际上却未能制造出这类化合物。下面以CC为例,用计算它的生 成焓来说明其稳定性,先写出CrCI的玻恩-哈伯热化学循环(类似于NaCI)。 CrCl(s) Cr+(g)+Cl-(g) L 个I 个Ea Cr(g) 十 C1(g) -△Hm0 个S 个1/2B Cr(s)+1/2 Cl2(g) L=(S+I)cr+(1/2B+Ea)CI-A Hm 0 Cr+的半径估计约为100pm,rc.=181pm,根据晶格能的理论计算公式 L=1.214×105×2×1×1(1-34.5/281)/281=758kJmo1 代入相应的热力学数据,有 △Hm(CrC1)=397+653+121.7-368.5-758=45kJmo1
四 晶格能在无机化学中的应用 1 计算假想化合物的生成焓 例如, 从Cr原子的价层结构3d 54s 1来看,Cr失去1个4s电子后成为3d 5半充 满构型。这种结构似应是稳定的,因而似应有CrX(X=F、Cl、Br、I)化合物 存在,但实际上却未能制造出这类化合物。下面以CrCl为例,用计算它的生 成焓来说明其稳定性,先写出CrCl的玻恩-哈伯热化学循环(类似于NaCl)。 CrCl(s) Cr+(g) + Cl-(g) L I Ea Cr(g) + Cl(g) -△fHm S 1/2 B Cr(s) + 1/2 Cl2 (g) Cr+的半径估计约为100 pm, rCl-=181 pm, 根据晶格能的理论计算公式 L= 1.214×105×2×1×1(1-34.5/281)/281=758 kJmol-1 代入相应的热力学数据,有 △fHm (CrCl)= 397+653+121.7-368.5-758=45 kJmol-1 L =(S+I)Cr+(1/2 B+Ea)Cl-△fHm

计算出来的生成焓是正值,且由Cr和CL,生成CCI是熵减的 反应(△Gm>45kJmo-l),表明CrCl即使能生成也是一个不大 稳定的化合物。事实上,它可能发生下述歧化反应。 2 CrCI(s)=CrCl,(s)+Cr(s) △Hm9/kJ.mol- 45 -396 0 △Gm6≈△Hm9=(-396)-2×45 =-486 kJmol-1 此反应的自由能变为较大的负值,说明向右进行的趋势很 大。因此,即使能生成CCl,也会按上式发生歧化反应。所以 CrCl是不稳定的
此反应的自由能变为较大的负值,说明向右进行的趋势很 大。因此,即使能生成CrCl,也会按上式发生歧化反应。所以 CrCl是不稳定的。 计算出来的生成焓是正值,且由Cr和Cl2生成CrCl是熵减的 反应(△fGm >45 kJmol-1 ), 表明CrCl即使能生成也是一个不大 稳定的化合物。事实上,它可能发生下述歧化反应。 2 CrCl(s)= CrCl2 (s)+Cr(s) △fHm / kJmol-1 45 -396 0 △fGm ≈△rHm =(-396)- 2×45 =-486 kJmol-1

2指导无机化合物的合成 像CC1一样,应用晶格能和玻恩-哈伯热化学循环,可以 计算出迄今未知的离子化合物的生成焓或反应焓,用以予计合 成这种无机化合物的可能性。 例1稀有气体化合物的合成 在这方面,一个十分突出而又引人入胜的事例,便是1962年 加拿大化学家N.Bartlett(巴列特)用这个方法合成了世界上第 个稀有气体化合物Xe[PF6]。这在当时轰动了整个科学界,并由 此打开了稀有气体化学的大门。 巴列特在研究PtF6这种极强氧化剂的性质时,发现只要将O, 与PF6混合在一起,PtC16就能从O2分子中将电子夺走并生成产物 六氟合铂酸氧分子O2PtF6]。 O2+PtF6=O2[PtF6]
2 指导无机化合物的合成 例1 稀有气体化合物的合成 在这方面, 一个十分突出而又引人入胜的事例,便是1962年 加拿大化学家 N.Bartlett(巴列特) 用这个方法合成了世界上第一 个稀有气体化合物Xe[PtF6 ]。这在当时轰动了整个科学界,并由 此打开了稀有气体化学的大门。 巴列特在研究PtF6这种极强氧化剂的性质时,发现只要将O2 与PtF6 混合在一起,PtCl6就能从O2分子中将电子夺走并生成产物 六氟合铂酸氧分子O2 [PtF6 ]。 O2 + PtF6 = O2 [PtF6 ] 像CrCl一样,应用晶格能和玻恩-哈伯热化学循环,可以 计算出迄今未知的离子化合物的生成焓或反应焓,用以予计合 成这种无机化合物的可能性
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)15 离子盐类溶解性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)13 配体强场对元素氧化态稳定性的影响(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)12 硼烷化学(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)11 平衡态和标准态(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)10 热力学稳定性和动力学稳定性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第八章 d区过渡元素(叙述化学).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第十章 f 区过渡元素.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第四章 无机固体化学.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第五章 S区元素.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第二章 酸碱和熔剂化学.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第三章 无机化合物的制备和表征.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第十二章 放射性和核化学.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第十一章 无机元素的生物学效应.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第九章 d区过渡元素(有机金属化合物、簇合物).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第七章 d区过渡元素(配位化合物).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第六章 P区元素.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第一章 原子、分子及元素周期性.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第六章 胶体分散体系和大分子溶液.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第五章 界面现象.ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)17 键焓及其共价型物质的热化学性质(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)18 多重平衡与化学计算(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)19 对镧系元素氧化态度热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)01 镧系元素的性质及其性质递变规律性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)20 对第一过渡系元素的氧化还原性的讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)21 元素电势图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)22 电势-pH图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)23 电极电势的热力学讨论、氧化还原反应(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)24 离子型化合物的稳定性——大大及小小规则(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)25 过渡系元素的磁性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)26 自由能-氧化态图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)27 配合物稳定性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)28 对Cu的价态稳定性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)29 关于Cu、Ag、Au和Zn、Cd、Hg活泼性的讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)02 自由能变和标准自由能变(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)03 周期反常现象(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)05 无机化学中的热力学问题(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)06 无机化学中的耦合现象(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)07 无机化学中常见图形简介(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)08 无机高分子(PPT).ppt
