西北大学:《中级无机化学》课程教学课件(PPT讲稿)第十一章 无机元素的生物学效应

第11章无机元素的生物学效应 生物分子 细胞 生物元素 无机元素的生物学效应
第11章 无机元素的生物学效应 生物分子 细胞 生物元素 无机元素的生物学效应

11.1生物分子 一个活的机体必须具有信息传递、生殖、新陈代谢、调 节和适应环境等功能。从化学角度上看,这些功能无非是生 物分子之间有组织的化学反应的表现,无机元素的生物学效 应大多是通过与生物分子的相互作用而发生的。在大多数情 况下,金属元素在生物体内不以自由离子形式存在,而是与 配体形成生物分子金属配位化合物。因此,在本质上金属元 素与生物分子的作用都属于配位化学范畴。那些存在于生物 体内、具有生物功能并与金属配位的配位体称为生物配体。 生物配体大体可分为三类: ()简单阴离子如F-、CI-、B-、I-、OH-、SO4-、 HC03-和HPO2-等; (2)小分子物质如水、氢气、氨、卟啉、咕啉、核苷酸 和氨基酸等; 3)大分子物质如蛋白质、多糖和核酸等
11.1 生物分子 一个活的机体必须具有信息传递、生殖、新陈代谢、调 节和适应环境等功能。从化学角度上看,这些功能无非是生 物分子之间有组织的化学反应的表现,无机元素的生物学效 应大多是通过与生物分子的相互作用而发生的。在大多数情 况下,金属元素在生物体内不以自由离子形式存在,而是与 配体形成生物分子金属配位化合物。因此,在本质上金属元 素与生物分子的作用都属于配位化学范畴。那些存在于生物 体内、具有生物功能并与金属配位的配位体称为生物配体。 生物配体大体可分为三类: (1) 简单阴离子如F-、Cl-、Br-、I-、OH-、SO4 2-、 HCO3 -和HPO4 2-等; (2) 小分子物质如水、氢气、氨、卟啉、咕啉、核苷酸 和氨基酸等; (3) 大分子物质如蛋白质、多糖和核酸等

11.1.1氨基酸、多肽和蛋白质 蛋白质是是由L型的a一氨基酸通过肽键一CONH一组合而 成。蛋白质可降解为较小的肽,肽进一步水解成为氨基酸。 在氨基酸分子HOOC一CH一R中,侧链R可以是羟基、巯 NH2 基、苯环、烃基和杂环等。正是具有不同特征侧链的氨基酸的不 同排列顺序,才形成了各种各样的具有不同生物功能的蛋白质。 个氨基酸的α一羧基与另一氨基酸的α一氨基通过脱水缩合 形成而使两个氨基酸连接起来: Ri H2N-CH-COOH H2N-CH-COOH- -H20 R2 HN-CH÷C-NCH-COOH 肽键 R, ●带年。年中单带年带单9
11.1.1 氨基酸、多肽和蛋白质 蛋白质是是由L型的α-氨基酸通过肽键-CONH-组合而 成。蛋白质可降解为较小的肽,肽进一步水解成为氨基酸。 在氨基酸分子HOOC-CH-R中,侧链R可以是羟基、巯 NH2 基、苯环、烃基和杂环等。正是具有不同特征侧链的氨基酸的不 同排列顺序,才形成了各种各样的具有不同生物功能的蛋白质。 一个氨基酸的α-羧基与另一氨基酸的α-氨基通过脱水缩合 一个氨基酸的 形成而使两个氨基酸连接起来 α-羧基与另一氨基酸的 : α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R2 一个氨基酸的 α-羧基与另一氨基酸的 α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R1 O H R2 一个氨基酸的 α-羧基与另一氨基酸的 α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R1 O H R2 一个氨基酸的 α-羧基与另一氨基酸的 α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R1 O H R2 一个氨基酸的 α-羧基与另一氨基酸的 α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R1 O H R2
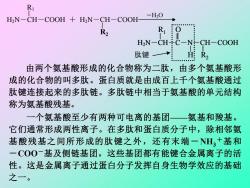
R H2N-CH-COOH H2N-CH-COOH-H2O R2 R :O HN-CH÷C-N:CH-COOH 肽键一→ 由两个氨基酸形成的化合物称为二肽,由多个氨基酸形 成的化合物的叫多肽。蛋白质就是由成百上千个氨基酸通过 肽键连接起来的多肽链。多肽链中相当于氨基酸的单元结构 称为氨基酸残基。 一个氨基酸至少有两种可电离的基团一氨基和羧基。 它们通常形成两性离子。在多肽和蛋白质分子中,除相邻氨 基酸残基之间所形成的肽键之外,还有末端一H3+基和 一COO一基及侧链基团。这些基团都有能键合金属离子的活 性。这是金属离子通过蛋白分子发挥自身生物学效应的基础 之一
由两个氨基酸形成的化合物称为二肽,由多个氨基酸形 成的化合物的叫多肽。蛋白质就是由成百上千个氨基酸通过 肽键连接起来的多肽链。多肽链中相当于氨基酸的单元结构 称为氨基酸残基。 一个氨基酸至少有两种可电离的基团——氨基和羧基。 它们通常形成两性离子。在多肽和蛋白质分子中,除相邻氨 基酸残基之间所形成的肽键之外,还有末端-NH3 +基和 -COO-基及侧链基团。这些基团都有能键合金属离子的活 性。这是金属离子通过蛋白分子发挥自身生物学效应的基础 之一。 一个氨基酸的 α-羧基与另一氨基酸的 α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R2 一个氨基酸的 α-羧基与另一氨基酸的 α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R1 O H R2 一个氨基酸的 α-羧基与另一氨基酸的 α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R1 O H R2 一个氨基酸的 α-羧基与另一氨基酸的 α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R1 O H R2 一个氨基酸的 α-羧基与另一氨基酸的 α-氨基通过脱水缩合形成肽键 R1 H2N-CH-COOH + H2N-CH-COOH H2N-CH-C-N-CH-COOH 肽键 而使两个氨基酸连接起来。由两个氨基酸形成的化合物称为二肽,由多个氨基酸形成的化合物的叫 -H2O R1 O H R2

由于蛋白质在几乎所有的生物过程中都起着极其重要 的作用,因此研究蛋白质的结构与功能的关系是从分子水 平上去认识生命现象的一个重要方面。 从氨基酸到肽,体现了从量变到质变的飞跃,从简单 的多肽到蛋白质又是一个飞跃。蛋白质已不是一种简单的 有机化合物。蛋白质的分子量可高达06,小的也在104以 上。蛋白质结构十分复杂,除氨基酸组成序列这种一级结 构之外,还有更高级的二级、三级以及四级结构
由于蛋白质在几乎所有的生物过程中都起着极其重要 的作用,因此研究蛋白质的结构与功能的关系是从分子水 平上去认识生命现象的一个重要方面。 从氨基酸到肽,体现了从量变到质变的飞跃,从简单 的多肽到蛋白质又是一个飞跃。蛋白质已不是一种简单的 有机化合物。蛋白质的分子量可高达l0 6 ,小的也在104以 上。蛋白质结构十分复杂,除氨基酸组成序列这种一级结 构之外,还有更高级的二级、三级以及四级结构

11.1.2酶 酶是一类特殊的具有专一催化活性的蛋白质。通常按 其所作用的底物的名称来命名,所谓底物是指与酶作用的 化合物。如催化H,O,分解的酶称为过氧化氢酶。与人工催 化剂相比,酶的催化效率高,具有高度的专一性,反应条 件温和。不同细胞内的酶系统不同,而且不同的酶系统又 有不同的生物控制系统,从而保证了生物体内的反应在规 定部位按规定程序和规定程度进行,确保生命活动的高度 有序性
11.1.2 酶 酶是一类特殊的具有专一催化活性的蛋白质。通常按 其所作用的底物的名称来命名,所谓底物是指与酶作用的 化合物。如催化H2O2分解的酶称为过氧化氢酶。与人工催 化剂相比,酶的催化效率高,具有高度的专一性,反应条 件温和。不同细胞内的酶系统不同,而且不同的酶系统又 有不同的生物控制系统,从而保证了生物体内的反应在规 定部位按规定程序和规定程度进行,确保生命活动的高度 有序性

一 酶的分类 酶分为两类: 单纯蛋白酶; 结合蛋白酶。 前者只含蛋白质; 后者由酶蛋白和辅基(或辅酶)两部分所组成。 酶蛋白指的是酶分子中的蛋白质部分; 辅基或辅酶是酶中的非蛋白质部分,它们可以是一些 小分子的有机物或金属离子,如维生素B12、血红素、Zn2+ 等。辅基与酶蛋白结合牢固,不易分离;而辅酶与酶蛋白 结合疏松,用透析的方法就可使其分离
酶分为两类: 单纯蛋白酶; 结合蛋白酶。 前者只含蛋白质; 后者由酶蛋白和辅基(或辅酶)两部分所组成。 酶蛋白指的是酶分子中的蛋白质部分; 辅基或辅酶是酶中的非蛋白质部分,它们可以是一些 小分子的有机物或金属离子,如维生素B12、血红素、Zn2+ 等。辅基与酶蛋白结合牢固,不易分离;而辅酶与酶蛋白 结合疏松,用透析的方法就可使其分离。 一 酶的分类

在已发现的3000多种酶中,有1/4至1/3需要金属离子 参与才能充分发挥它们的催化功能。 按照酶对金属亲合力的大小,可以将这些酶划分为金 属酶和金属激活酶。 金属酶中的酶蛋白与金属离子结合得比较牢固且金属 离子处于酶的活性中心。 金属激活酶与金属离子的结合不如金属酶牢固,且金 属离子不在酶的活性中心处。 在提取分离过程中,金属酶一般不会发生金属离子的 解离丢失现象,而金属激活酶则常要发生金属离子的解离。 金属离子丢失会导致酶活性消失,不过在加入适当金属离 子后,酶的活性一般可以重新获得
在已发现的3 000多种酶中,有1/4至1/3需要金属离子 参与才能充分发挥它们的催化功能。 按照酶对金属亲合力的大小,可以将这些酶划分为金 属酶和金属激活酶。 金属酶中的酶蛋白与金属离子结合得比较牢固且金属 离子处于酶的活性中心。 金属激活酶与金属离子的结合不如金属酶牢固,且金 属离子不在酶的活性中心处。 在提取分离过程中,金属酶一般不会发生金属离子的 解离丢失现象,而金属激活酶则常要发生金属离子的解离。 金属离子丢失会导致酶活性消失,不过在加入适当金属离 子后,酶的活性一般可以重新获得

金属离子在活化各种酶时的功能大致可以归结为: ()固定酶蛋白的几何构型,以保证只有特定结构的 底物才可与之结合; (2)通过与底物和酶蛋白形成混合配合物而使底物与 酶蛋白相互靠近,从而有助于酶蛋白发生作用; (3)在反应中作为电子传递体,使底物被氧化或被还 原
金属离子在活化各种酶时的功能大致可以归结为: (1) 固定酶蛋白的几何构型,以保证只有特定结构的 底物才可与之结合; (2) 通过与底物和酶蛋白形成混合配合物而使底物与 酶蛋白相互靠近,从而有助于酶蛋白发生作用; (3) 在反应中作为电子传递体,使底物被氧化或被还 原

二酶的作用机理学说 1锁钥学说 锁钥学说认为酶与底物的关系如同锁和钥匙的关系一 样。酶分子像一把锁,而底物像一把钥匙。当酶和底物的 空间构像正好能相互完全弥合时,才能像钥匙将锁打开一 样,产生相互作用。 这种比喻一方面说明了酶催化的专一性,另一方面也 说明了酶与其作用的底物之间的复杂空间关系
二 酶的作用机理学说 1 锁钥学说 锁钥学说认为酶与底物的关系如同锁和钥匙的关系一 样。酶分子像一把锁,而底物像一把钥匙。当酶和底物的 空间构像正好能相互完全弥合时,才能像钥匙将锁打开一 样,产生相互作用。 这种比喻一方面说明了酶催化的专一性,另一方面也 说明了酶与其作用的底物之间的复杂空间关系
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第九章 d区过渡元素(有机金属化合物、簇合物).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第七章 d区过渡元素(配位化合物).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第六章 P区元素.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第一章 原子、分子及元素周期性.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第六章 胶体分散体系和大分子溶液.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第五章 界面现象.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第三章 溶液.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第一章 热力学第一定律及其应用.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第八章 化学动力学基础.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第七章 化学平衡.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第四章 相平衡.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学资源(PPT课件讲稿)绪论.ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)第五章 化学平衡与滴定分析法概论、第六章 酸碱滴定法.pptx
- 《分析化学》课程教材:《分析化学》书籍PDF电子版(武汉大学,第四版).pdf
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)第九章 沉淀滴定法、第十章 沉淀重量分析法.ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)络合滴定指示剂、配位滴定条件的选择、氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)酸碱滴定法的基本原理、多元酸(碱)的滴定、络合滴定法(配位滴定).ppt
- 石河子大学:《分析化学》课程PPT教学课件(化工专业)第一章 绪论、第四章 误差与实验数据的处理(主讲:陈思羽).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第十二章 放射性和核化学.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第三章 无机化合物的制备和表征.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第二章 酸碱和熔剂化学.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第五章 S区元素.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第四章 无机固体化学.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第十章 f 区过渡元素.ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第八章 d区过渡元素(叙述化学).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)10 热力学稳定性和动力学稳定性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)11 平衡态和标准态(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)12 硼烷化学(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)13 配体强场对元素氧化态稳定性的影响(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)15 离子盐类溶解性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)16 晶格能及其应用(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)17 键焓及其共价型物质的热化学性质(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)18 多重平衡与化学计算(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)19 对镧系元素氧化态度热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)01 镧系元素的性质及其性质递变规律性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)20 对第一过渡系元素的氧化还原性的讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)21 元素电势图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)22 电势-pH图及其应用.pdf
